Klórsav
| klórsav | |||
 klórsav | |||
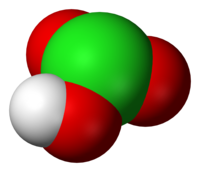 klórsav | |||
| Más nevek | klór(V) sav | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 7790-93-4 | ||
| ChemSpider | 18513 | ||
| |||
| |||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | HClO3 | ||
| Moláris tömeg | 84,45914 g mol−1 | ||
| Megjelenés | színtelen oldat | ||
| Sűrűség | 1 g/ml, oldat (körülbelül) | ||
| Oldhatóság (vízben) | >40 g/100 ml (20 °C) | ||
| Savasság (pKa) | kb. −2,7[1] | ||
| Kristályszerkezet | |||
| Molekulaforma | trigonális piramis | ||
| Veszélyek | |||
| Főbb veszélyek | oxidálószer, korrozív | ||
| NFPA 704 | |||
| Rokon vegyületek | |||
| Azonos kation | brómsav jódsav | ||
| Azonos anion | ammónium-klorát nátrium-klorát kálium-klorát | ||
| Rokon vegyületek | sósav hipoklórossav klórossav perklórsav | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A klórsav a klór egyik oxosava, sói a klorátok, képlete HClO3. Erős sav (pKa ≈ −2,7) és erős oxidálószer.
Bárium-klorát és kénsav reakciójával lehet előállítani, a folyamat során a vízben oldhatatlan bárium-szulfát csapadékként leválik:
- Ba(ClO3)2 + H2SO4 → 2HClO3 + BaSO4
Elő lehet állítani hipoklórossav melegítésével is:
- 3HClO → HClO3 + 2 HCl
Hideg vizes oldata maximum mintegy 30%-os töménységig stabil. 30%-40%-os oldatot csökkentett nyomáson történő bepárlással lehet előállítani. Ennél töményebb oldatokban vagy melegítés hatására a klórsav bomlik:[2]
- 8 HClO3 → 4 HClO4 + 2 H2O + 2 Cl2 + 3 O2
- 3 HClO3 → HClO4 + H2O + 2 ClO2
Bomlását kinetikai tényezők befolyásolják, a klórsav a diszproporcióval szemben termodinamikailag nem stabil.
A klórsav veszélyesen erős oxidálószer, a legtöbb szerves és éghető anyaggal érintkezve azokat hirtelen elégeti. Például ha cukor és kálium-klorát elegyéhez tömény kénsavat adunk, akkor a keverék – a keletkező klórsav hatására – meggyullad.
Molekulaalkata a vegyértékelektronpár-taszítási elmélet szerint trigonális piramis. A klórsav molekulái az oldatban szinte teljes egészében disszociálódnak. A klorátionok igen gyenge bázisok. Oxidálóképessége savas közegben erősebb, mint bázisos körülmények között, amit a redoxpotenciálok értéke is mutat:[3]
| redox pár | oxidációs szám | standardpotenciál pH = 0 | standardpotenciál pH = 14 |
|---|---|---|---|
| HClO4 /HClO3 | (+VII)/(+V) | +1,19 V | +0,36 V |
| HClO3 /ClO2 | (+V)/(+IV) | ? | ? |
| HClO3 /HClO2 | (+V)/(+III) | ? | ? |
| HClO3 /HClO | (+V)/(+I) | +1,43 V | +0,50 V |
| HClO3 /Cl2 | (+V)/(0) | +1,47 V | +0,48 V |
| HClO3 /Cl− | (+V)/(−I) | +1,45 V | +0,62 V |
Jegyzetek szerkesztés
- ↑ Nils Wiberg – Egon Wiberg – Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. (németül) 102. Berlin: De Gruyter. 2007. ISBN 978-3-11-017770-1
- ↑ Greenwood, N.N.. Az elemek kémiája, 1., Budapest: Nemzeti Tankönyvkiadó, 1175. o. (1999). ISBN 963-18-9144-5
- ↑ Nils Wiberg – Egon Wiberg – Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. (németül) 91-100. Berlin: De Gruyter. 1985. 420. o. ISBN 3-11-007511-3
Fordítás szerkesztés
Ez a szócikk részben vagy egészben a Chloric acid című angol Wikipédia-szócikk fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Ez a szócikk részben vagy egészben a Chlorsäure című német Wikipédia-szócikk fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források szerkesztés
- szerk.: R. Bruce King: Chloric acid, Encyclopedia of Inorganic Chemistry 2. Chichester: Wiley (1994). ISBN 0-471-93620-0
