Monoklonális antitest
A monoklonális antitestek olyan antitestek (ellenanyagok) amelyeket egyetlen fehérvérsejtből kiinduló, klónozott sejtvonal termel, így szerkezetileg egységesek és egy bizonyos antigén egy bizonyos epitopjához kötődnek (szemben a poliklonális antitestekkel, amelyeket több sejt állít elő és a célmolekula több pontjához kötődnek változó hatékonysággal). Molekuláris biológiai módszerekkel, két ellenanyagmolekula összekötésével olyan monoklonális antitestek is előállíthatók, amelyek két epitophoz is kötődnek.
Monoklonális antitestek szinte minden nagyobb molekula ellen előállíthatóak és specifikus kötődésük miatt a kutatásban, az orvostudományban, az iparban egyaránt széleskörűen használják őket a célmolekula detektálására vagy tisztítására. A gyógyításban súlyos betegségek diagnosztizálására és terápiájára is felhasználhatóak.[3] Újabban a Covid19 tüneteinek egyhítésére alkalmazzák.[4]
Kutatástörténet szerkesztés
A Nobel-díjas Paul Ehrlich már az 1900-as években felvetette az immunológiai "varázslövedék" (Zauberkugel) lehetőségét: egy olyan vegyületet, amely specifikusan kötődik a kórokozóhoz és a hozzákötött toxinnal el is pusztítja azt. Ennek megvalósításához azonban akkor még hiányzott a megfelelő technológiai háttér.
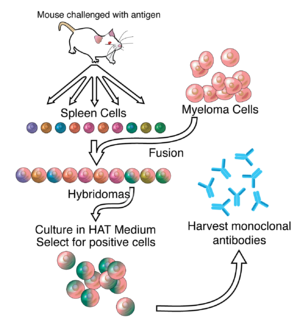
Az 1970-es évekre felfedezték, hogy az antitesteket termelő B-limfociták tumora (mielóma multiplex) során létrejönnek olyan, kontrollálatlanul növekvő sejtvonalak, amelyek egy bizonyos antitest-molekulát állítanak elő. Ezeket az abnormális antitesteket (többnyire a teljes fehérje csak egy részét, pl. a könnyű láncot tartalmazták) előszeretettel használták az ellenanyagok szerkezetének kutatásában, de ekkor még nem volt lehetséges egy konkrét antigén ellen termeltetni azonos antitesteket.[5]:324 1973-ban az amerikai Jerrold Schwaber először állított elő ún. hibridómákat: emberi limfocitákat egyesítettek egér mielómás tumorsejtekkel.[6] Két évvel később a német Georges Köhler és az argentin César Milstein olyan hibridómákat állított elő, amelyek egy adott antigén ellen termeltek ellenanyagot és immortalizáltak voltak (a végtelenségig képesek voltak osztódni).[7] Ők ketten (Niels Kaj Jernével megosztva) a munkájukért 1984-ben elnyerték az orvostudományi Nobel-díjat.[7]
1988-ban Gregory Winternek és csapatának sikerült "humanizálnia" (az emberéhez hasonlóvá tennie) a monklonális antitesteket,[8] megszüntetve így az immunrekaciót, amely egyes betegekben jelentkezett az antitestek beadása után. Az 1990-es években megkezdődtek a kísérletek a monoklonális antitestek terápiás alkalmazására. 2018-ban James P. Allison és Hondzso Taszuku orvosi Nobel-díjban részesült új tumerterápiás módszerükért, melyben monklonális antitestekkel akadályozták meg az immunválasz gátlását.[9]
Előállítása szerkesztés
A hibridómák előállítása szerkesztés
A monoklonális antitestek termelésében a legnagyobb feladat a megfelelő hibridómák előállítása, ezen belül azoknak a hibrid sejteknek az azonosítása, amelyek a szükséges ellenanyagot termelik.[7] Erre a célra általában nyúlsejteket használnak. A lép sejtjeit összekeverik a mielómasejtekkel, majd polietilén-glikol segítségével fuzionáltatják az egymás melletti sejtek plazmamembránját.[10] A fúzió hatásfoka eléggé alacsony, ezért olyan szelektív tenyésztőközeget használnak, amelyben csak a hibrid sejtek képesek osztódni hosszabb távon. A folyamatban alkalmazott mielómasejtekben elrontották a hipoxantin-guanin foszforiboziltranszferáz (HGPRT) enzimet, amely a nukleinsavak újrahasznosításához szükséges. Az enzim hiánya önmagában nem okoz gondot, de ha a nukleinsavak újonnan való szintézisét is blokkolják (pl. aminopterinnel), a sejt képtelen osztódni.
Mivel a szelektív tápközeg aminopterint tartalmaz, a nem fuzionáló mielómasejtek nem tudnak szaporodni, a nem fuzionáló lépsejtek pedig néhány osztódás után természetes módon elpusztulnak, így hosszabb távon csak a hibridómák maradnak életben, amelyek a mielóma felük miatt immortalizáltak (mint a tumorsejtek), plazmasejt felük után pedig tartalmaznak HGPRT enzimet.
A fenti sejtkeveréket annyira felhígítják, hogy a tápközeget szétosztva a további tenyésztést egy-egy sejtből tudják folytatni, vagyis klónozzák őket. Ezután valamilyen immunoassay teszttel (ELISA, antigén microarray, dot blot) megvizsgálják az egyes sejtklónok által termelt ellenanyagok kötődési képességét a kívánt antigénhez és a legbiztosabb, legstabilabb klónt viszik tovább az ipari szintű termelésbe.
Megfelelő tápközegben a hibridómák a végtelenségig tenyészthetők. Esetenként egér hashártyaüregébe injektálják, ahol a sejtek tumorokat alkotnak, amely ellenanyagokban gazdag folyadékot választ ki (utóbbi módszert etikai okokból csak akkor használják, ha más alternatíva nem áll rendelkezésre).[11]
A hagyományos hibrima-nódszer mellett új technológiákkal is kísérleteznek;[12] ezekben többnyire az ellenanyag könnyű és nehéz láncát viszik be rekombináns módszerekkel baktériumokba vagy emlőssejtekbe, amelyeket hatékonyabban lehet tenyészteni és a nyúlon kívül másfajta sejteket is használhatnak.
A megtermelt ellenanyagot a sejttenyészet felülúszójából vagy a hashártyafolyadékból nyerik ki különböző tisztítási lépésekkel (szűrés, ioncserélő kromatográfia vagy affinitás-kromatográfia).
A monoklonális ellenanyagot molekuláris biológiai módszerekkel (klónozás, CRISPR/Cas9, fág- vagy élesztő-display)tovább lehet fejleszteni.[13] Az ellenanyag génjének kissé módosított változatait beviszik egy vírus vagy élesztőgomba genomjába, majd a megfelelő szűrőmódszerekkel kiválasztják azokat a verziókat, amelyek a legjobban kötnek, legstabilabbak, leghatékonyabbak a terápiában, stb.[14] The phage antibody libraries are a variant of phage antigen libraries.[15][16] A vírusok és az élesztőgombák alkalmasabbak is az ipari léptékű, fermentációs tartályokban történő termelésre, mint az érzékenyebb emlőssejtek.
Kiméra ellenanyagok szerkesztés
A terápiában felhasznált monoklonális ellenanyagokat korábban állatokban (egérben) állították elő, és gyakran immunválaszt lépett fel az idegen eredetű antitestekkel szemben. A probléma megoldására kiméra-antitesteket hoztak létre ("humanizálták" az egér-ellenanyagot), melyben csak a immunglobulin-molekula variábilis (antigénhez kötődő) része származott az egérből, a többi emberi eredetű volt.[17][18] Mivel kisebb mellékhatások így is eéőfordultak, újabban a terápiás monoklonális ellenanyagok teljesen humán eredetűek, vagyis olyan transzgénikus egerekben fejlesztik őket, amelyek immunglobulin-génjeit emberire cserélték.[19]
Felhasználása szerkesztés
Diagnosztikus tesztek, analitikai eljárások szerkesztés
Egy adott molekula ellen készített monoklonális ellenanyagok a későbbiekben felhasználhatóak a molekula detektálására. Jellemzően fehérjéket detektálnak így, Western blot vagy immuno dot blot módszerrel. Az immunhisztokémiai vizsgálatok során monoklonális ellenanyagokkal mutatják ki a fixált szövettani metszetekben az egyes antigéneket, amelyeket a fagyasztott mintákban vagy élő sejtekben immunfluoreszcenciával lehet detektálni.
A keverékekből immunprecipitációs eljárással lehet kiválasztani a kívánt vegyületet.
Terápiás felhasználás szerkesztés
A monoklonális ellenanyagok különböző módokon segíthetnek a betegségek gyógyításában, például blokkolhatnak bizonyos biokémiai folyamatokat, apoptózist indukálhatnak a célmolekulát hordozó sejtekben, megváltoztathatják a szervezet biokémiai szignáljait.[20][21]
A tumorok kezelésének egyik módja, hogy monoklonális ellenanyagokat kapcsolnak a tumorspecifikus sejtfelszíni molekulákhoz, így a sejtek ellen immunválasz indukálható. Más esetekben az ellenanyaghoz toxin, radioaktív izotóp, citokin, esetleg egy másik ellenanyag köthető; utóbbival a szervezet egy másik fehérjéje vagy sejtje kapcsolható a célsejthez.
A TNF-α szignálproteinhez kötő infliximab és adalimumab fantázianevű monoklonális ellenanyagokat olyan autoimmun betegségek kezeléséhez használják, mint a rheumatoid arthritis, Crohn-betegség, fekélyes vastagbélgyulladás vagy Bechterew-kór.[23] A basiliximab és a daclizumab az interleukin 2-t blokkolja, így megelőzi az átültett szervek (pl. vese) kilökődését.[23] Az immunglobulin E-hez kötő omalizumab a súlyos allergiás asztmarohamok enyhítésére alkalmas.
2021-ben úgy tapasztalták, hogy koronavírusos betegek esetében a bamlanivimab/etesevimab és casirivimab/imdevimab monoklonális antitest alapú gyógyszerek adagolásával csökkenteni lehet a kórházi ápolás idejét és a halálozás esélyét,[24][25] így az Egyesült Államokban engedélyezték használatukat Covid19 esetén.[24][25] Később az in vitro neutralizálási tesztek során kiderült, hogy a monoklonális ellenanyag alapú gyógyszerek (a sotrovimab és tixagevimab/cilgavimab kivételével) nem hatékonyak az omikron variánssal szemben.[26]
Az alábbi táblázatban néhány terápiás monoklonális ellenanyag jellemzői láthatók:
| Típus | Név | Kórkép | Mechanizmus | Eredet |
|---|---|---|---|---|
| Gyulladáscsökkentő | infliximab[23] | gátolja a TNF-α-t | kiméra | |
| adalimumab | gátolja a TNF-α-t | humán | ||
| ustekinumab | gátolja az interleukin IL-12-t és IL-23-at | humán | ||
| basiliximab[23] |
|
gátolja az IL-2-t az aktivált T-sejteken | kiméra | |
| daclizumab[23] |
|
gátolja az IL-2-t az aktivált T-sejteken | humanizált | |
| omalizumab |
|
gátolja az immunglobulin E-t (IgE) | humanizált | |
| Rákellenes | gemtuzumab[23] | a CD33 molekulához kötődik a leukémiás sejtek felszínén | humanizált | |
| alemtuzumab[23] |
|
a CD52 molekulához kötődik a T- és B-sejtek felszínén | humanizált | |
| rituximab[23] |
|
a CD20 mokelulához kötődik a B-limfociták felszínén | kiméra | |
| trastuzumab |
|
a HER2/neu onkogén receptorához kötődik | humanizált | |
| nimotuzumab | EGFR inhibitor | humanizált | ||
| cetuximab |
|
EGFR inhibitor | kiméra | |
| bevacizumab, ranibizumab |
|
VEGF inhibitor | humanizált | |
| Rák- és vírusellenes | bavituximab[27] |
|
immunterápia, célpontja a foszfatidil-szerin[27] | kiméra |
| Anti-viral |
|
immunterápia, a SARS-CoV-2 felszíni fehérjéjéhez köt | kiméra | |
| bamlanivimab/etesevimab[24] |
|
immunterápia, a SARS-CoV-2 felszíni fehérjéjéhez köt | kiméra | |
| Sotrovimab[28] |
|
immunterápia, a SARS-CoV-2 felszíni fehérjéjéhez köt | kiméra | |
| Egyéb | palivizumab[23] |
|
gátolja a vírus fúziós proteinjét | humanizált |
| abciximab[23] |
|
gátolja a vérlemezkék GpIIb/IIIa receptorát | kiméra |
Mellékhatások szerkesztés
Egyes monklonális antitestek (pl. a bevacizumab és a cetuximab) különböző - súlyos és kevésbé súlyos - mellékhatásokat váltanak ki,[29][30] gyakran előfordul például szédülés, fejfájás, allergiás reakció, hasmenés vagy székrekedés, köhögés, láz, levertség, álmatlanság;[31] ritkán pedig súlyos kórképek is fellphetnek, mint anafliaxiás sokk, vérrögképződés, vérzés, a pajzsmirigy vagy a máj működésének zavarai, esetleg különböző gyulladások.[31]
Jegyzetek szerkesztés
- ↑ Cytochrome P450 Mediated Drug and Carcinogen Metabolism using Monoclonal Antibodies. home.ccr.cancer.gov . (Hozzáférés: 2018. április 2.)
- ↑ (1999. november 1.) „Inhibitory monoclonal antibodies to human cytochrome P450 enzymes: a new avenue for drug discovery”. Trends in Pharmacological Sciences 20 (11), 432–38. o. DOI:10.1016/S0165-6147(99)01382-6. PMID 10542439.
- ↑ Waldmann, Thomas A. (1991. június 21.). „Monoclonal Antibodies in Diagnosis and Therapy” (angol nyelven). Science 252 (5013), 1657–1662. o. DOI:10.1126/science.2047874. PMID 2047874.
- ↑ (2021. december 23.) „Time to knock monoclonal antibodies off the platform for patients hospitalised with COVID-19” (english nyelven). The Lancet Infectious Diseases. DOI:10.1016/S1473-3099(21)00762-3. ISSN 1473-3099. PMID 34953521.
- ↑ (1994. július 1.) „Monoclonal antibodies: a witness seminar in contemporary medical history”. Medical History 38 (3), 322–27. o. DOI:10.1017/s0025727300036632. PMID 7934322.
- ↑ (1973. augusztus 1.) „Human x mouse somatic cell hybrid clone secreting immunoglobulins of both parental types”. Nature 244 (5416), 444–47. o. DOI:10.1038/244444a0. PMID 4200460.
- ↑ a b c The Story of César Milstein and Monoclonal Antibodies. WhatisBiotechnology.org . (Hozzáférés: 2020. szeptember 23.)
- ↑ (1988. március 1.) „Reshaping human antibodies for therapy”. Nature 332 (6162), 323–27. o. DOI:10.1038/332323a0. PMID 3127726.
- ↑ (2018. november 1.) „A Nobel Prize-worthy pursuit: cancer immunology and harnessing immunity to tumour neoantigens”. Immunology 155 (3), 283–84. o. DOI:10.1111/imm.13008. PMID 30320408.
- ↑ Yang J1, Shen MH. "Polyethylene glycol-mediated cell fusion". Methods Mol Biol. 2006; 325:59–66.
- ↑ National Research Council (US) Committee on Methods of Producing Monoclonal Antibodies. Recommendation 1: Executive Summary: Monoclonal Antibody Production. Washington (DC): National Academies Press (US); 1999. ISBN 978-0-309-07511-4
- ↑ (2018. június 1.) „Inaugural Editorial: Searching for Magic Bullets”. Antibody Therapeutics 1 (1), 1–5. o. DOI:10.1093/abt/tby001. PMID 30101214.
- ↑ (2019. augusztus 1.) „Functional diversification of hybridoma-produced antibodies by CRISPR/HDR genomic engineering”. Science Advances 5 (8), eaaw1822. o. DOI:10.1126/sciadv.aaw1822. PMID 31489367.
- ↑ (2002. január 1.) „Recombinant monoclonal antibody technology”. Transfusion Clinique et Biologique 9 (1), 15–22. o. DOI:10.1016/S1246-7820(01)00210-5. PMID 11889896.
- ↑ Dr. George Pieczenik. LMB Alumni. MRC Laboratory of Molecular Biology (LMB), 2009. szeptember 17. [2012. december 23-i dátummal az eredetiből archiválva]. (Hozzáférés: 2012. november 17.)
- ↑ (2000) „Phage display: a molecular tool for the generation of antibodies – a review”. Placenta 21 Suppl A (Suppl A), S106–12. o. DOI:10.1053/plac.1999.0511. PMID 10831134.
- ↑ (1984. április 25.) „Production of functional chimaeric mouse/human antibody”. Nature 312 (5995), 643–46. o. DOI:10.1038/312643a0. PMID 6095115.
- ↑ (2001. április 1.) „Therapeutic antibody expression technology”. Current Opinion in Biotechnology 12 (2), 188–94. o. DOI:10.1016/S0958-1669(00)00198-1. PMID 11287236.
- ↑ (1995) „Human antibodies from transgenic mice”. International Reviews of Immunology 13 (1), 65–93. o. DOI:10.3109/08830189509061738. PMID 7494109.
- ↑ (2000. február 1.) „Therapeutic monoclonal antibodies”. Lancet 355 (9205), 735–40. o. DOI:10.1016/S0140-6736(00)01034-5. PMID 10703815.
- ↑ Australian Prescriber (2006). „Monoclonal antibody therapy for non-malignant disease”. Australian Prescriber 29 (5), 130–33. o. DOI:10.18773/austprescr.2006.079.
- ↑ (2001. november 1.) „Improving the efficacy of antibody-based cancer therapies”. Nature Reviews. Cancer 1 (2), 118–29. o. DOI:10.1038/35101072. PMID 11905803.
- ↑ a b c d e f g h i j Pharmacology. Edinburgh: Churchill Livingstone, 241, for the examples infliximab, basiliximab, abciximab, daclizumab, palivusamab, gemtuzumab, alemtuzumab and rituximab, and mechanism and mode. o. (2003). ISBN 978-0-443-07145-4
- ↑ a b c (9 February 2021). "FDA Authorizes Monoclonal Antibodies for Treatment of COVID-19". Sajtóközlemény. Ez a cikk ebből a forrásból származó szöveget tartalmaz, amely közkincs.
- ↑ a b c (21 November 2020). "Coronavirus (COVID-19) Update: FDA Authorizes Monoclonal Antibodies for Treatment of COVID-19". Sajtóközlemény. Ez a cikk ebből a forrásból származó szöveget tartalmaz, amely közkincs.
- ↑ (2021. december 1.) „Omicron overpowers key COVID antibody treatments in early tests”. Nature. DOI:10.1038/d41586-021-03829-0. PMID 34937889.
- ↑ a b Staff, Adis Insight. Bavituximab profile Last updated 27 January 2016
- ↑ Emergency Use Authorization letter (PDF). U.S. Food and Drug Administration (FDA) , 2021. december 16. (Hozzáférés: 2022. január 6.) Ez a cikk ebből a forrásból származó szöveget tartalmaz, amely közkincs.
- ↑ Monoclonal antibodies to treat cancer | American Cancer Society. www.cancer.org . (Hozzáférés: 2018. április 19.)
- ↑ „Monoclonal antibody drugs for cancer: How they work”, Mayo Clinic (Hozzáférés: 2018. április 19.)
- ↑ a b „Monoclonal Antibodies: List, Types, Side Effects & FDA Uses (Cancer)”, MedicineNet (Hozzáférés: 2018. április 19.)
Fordítás szerkesztés
- Ez a szócikk részben vagy egészben a Monoclonal antibody című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.