Egyszerű aromás gyűrű
Az egyszerű aromás gyűrűk, más néven egyszerű arének vagy egyszerű aromások olyan aromás szerves vegyületek, amelyek csak konjugált sík gyűrűt tartalmaznak, melyben delokalizált pi-elektronfelhő található. Számos egyszerű aromás vegyületnek van triviális neve. Gyakran bonyolultabb molekulák építőkövei (szubsztituált aromás vegyületek). Jellegzetes egyszerű aromás vegyületek például a benzol, az indol és a ciklotetradekaheptaén.[1][2]
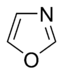
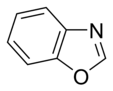
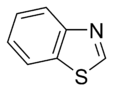
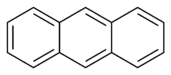
Az egyszerű aromás gyűrűk heterociklusok is lehetnek, ha gyűrűjükben a széntől különböző, például oxigén-, nitrogén- vagy kénatom található. Lehetnek monociklusok, mint a benzol, biciklusok, mint a naftalin vagy policiklusok, mint például az antracén. Az egyszerű, egy gyűrűt tartalmazó aromás vegyületek általában öt- vagy hattagú gyűrűvel rendelkeznek, mint a pirrol vagy a piridin. A kondenzált aromás gyűrűk olyan gyűrűkből állnak, melyeknek egyik oldala (kötése) közös.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
Heterociklusos aromás gyűrűk szerkesztés
A nitrogén (N)-tartalmú aromás gyűrű feloszthatók bázisos aromás gyűrűkre – ezek könnyen protonálható, aromás kationokat és sókat képező (pl. piridínium) vegyületek–, valamint nem bázisos aromás gyűrűkre.
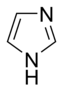
- A bázisos aromás gyűrűkben a nemkötő elektronpár nem része az aromás rendszernek és a gyűrű síkjában található. Az aminokhoz hasonlóan itt is ez a nemkötő elektronpár felelős az ilyen nitrogéntartalmú bázisok bázikusságáért. Ezekben a vegyületekben a nitrogénhez nem kapcsolódik hidrogén. Bázisos aromás vegyület például a piridin vagy a kinolin. Több olyan gyűrű is van, amelyben mind bázisos, mind nem bázisos nitrogén is található, ilyen például az imidazol és a purin.
- A nem bázisos gyűrűkben a nitrogén magányos elektronpárja delokalizálódik és az aromás pi-elektronrendszer tagja. Ezekben a vegyületekben a nitrogénatomhoz hidrogén kapcsolódik. Nem bázisos nitrogént tartalmazó aromás gyűrű például a pirrol és az indol.
Az oxigén- és kéntartalmú aromás gyűrűkben a heteroatom egyik elektronpárja (a nem bázisos nitrogéntartalmú gyűrűkhöz hasonlóan) az aromás rendszer tagja, míg egy másik magányos elektronpárjuk (a bázisos nitrogéntartalmú gyűrűkhöz hasonló módon) a gyűrű síkjában lokalizálódik.
Az aromásság feltételei szerkesztés
- A molekula gyűrűs alkatú.
- A gyűrűt alkotó minden atom rendelkezik betöltött p-pályával, melyek a szomszédos p-pályákkal átfednek (teljesen konjugált rendszer).
- A molekula síkalkatú.
- A molekulában páros számú pi-elektronpár található, mely kielégíti a Hückel-szabályt: (4n+2) pi-elektron, ahol n nem negatív egész szám.
A fentiekkel ellentétben a 4n pi-elektront tartalmazó molekulák antiaromásak.
Fordítás szerkesztés
Ez a szócikk részben vagy egészben a Simple aromatic ring című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Kapcsolódó szócikkek szerkesztés
Hivatkozások szerkesztés
- ↑ Clayden Jonathan, Nick Greeves, Stuart Warren, Peter Wothers. Organic chemistry. Oxford, Oxfordshire: Oxford University Press (2001). ISBN 0-19-850346-6
- ↑ Eicher, T.; Hauptmann, S.. The Chemistry of Heterocycles: Structure, Reactions, Syntheses, and Applications, 2nd ed., Wiley-VCH (2003. április 2.). ISBN 3-527-30720-6