Glioxál
| Glioxál | |||
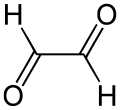 A glioxál szerkezete |
 A glioxálmolekula modellje | ||
| IUPAC-név | etándial | ||
| Más nevek | glioxál, oxálaldehid | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 107-22-2 | ||
| |||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C2H2O2 | ||
| Moláris tömeg | 58,04 g mol−1 | ||
| Megjelenés | Zöldessárga színű folyadék vagy sárga színű szilárd anyag | ||
| Sűrűség | 1,27 g cm−3 | ||
| Olvadáspont | 15 °C | ||
| Forráspont | 51 °C | ||
| Oldhatóság (vízben) | Jó (600 g/l) | ||
| Veszélyek | |||
| Főbb veszélyek | Ártalmas (Xn)[1] | ||
| R mondatok | R20, R36/38, R43, R68[1] | ||
| S mondatok | (S2), S36/37[1] | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A glioxál egy szerves vegyület, a legegyszerűbb dialdehid (két formilcsoportot tartalmazó aldehid) és egyben a legegyszerűbb dioxovegyület (két karbonilcsoportot tartalmazó oxovegyület). Az egyetlen 1,2-dialdehid (szomszédos formilcsoportokat tartalmazó dialdehid). Szobahőmérsékleten sárga színű kristályos anyag vagy zöldessárga színű folyadék. Olvadáspontja alacsony (15 °C). A gőzei is zöldessárga színűek. Szúrós szagú vegyület, vízben, alkoholban, éterben egyaránt jól oldódik.
Kémiai tulajdonságai szerkesztés
A glioxál mutatja az aldehidekre jellemző reakciókat. Könnyen képez addíciós származékokat. Könnyen képződik belőle acetál is. Redukálja az ammóniás ezüst-hidroxid oldatot is, az ezüsttükörpróbát tehát mutatja.
Két formilcsoportja egymásra elektronszívó hatást gyakorol. Emiatt a glioxál vízzel stabil hidrátot képez.
A glioxál a formaldehidhez hasonlóan könnyen polimerizálódik. Állás közben polimerizációval poliglioxállá alakul, ami fehér színű kristályos anyag. A poliglioxál polimer homológok keveréke. Lúgok vagy hevítés hatására depolimerizálódik, visszaalakul glioxállá.
Lúgok hatására már szobahőmérsékleten intramolekuláris Cannizzaro-reakcióba lép, és glikolsavvá alakul.
Előállítása szerkesztés
A glioxál etilénglikolból vagy acetaldehidből állítható elő oxidációval. Az etilénglikol gőzei 300 °C-on réz-oxid hatására glioxállá oxidálódnak.
Felhasználása szerkesztés
A glioxál könnyen lép kondenzációs reakcióba ammóniával és aminocsoportot tartalmazó vegyületekkel, emiatt heterociklusos vegyületek szintézisére használják. A műanyagipar is felhasználja.
Hidroxilammónium-klorid és glioxál hidrogén-szulfit-adduktumából protonakceptorral glioxim állítható elő.[2]
Jegyzetek szerkesztés
- ↑ a b c A glioxál (ESIS)[halott link]
- ↑ Lance KA. The synthesis and characterization of cobalt dioxygen carriers based on the bis(glyoximato) chelate. The Ohio State University (1988). Hozzáférés ideje: 2023. december 17.
Források szerkesztés
- Bruckner Győző: Szerves kémia, I/1-es kötet
- Furka Árpád: Szerves kémia
- Kovács Kálmán, Halmos Miklós: A szerves kémia alapjai