Jód-pentafluorid
| Jód-pentafluorid | |||
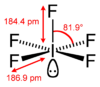 A jód-pentafluorid sztereoképlete |
 A jód-pentafluorid kalottamodellje | ||
| Szabályos név | pentafluor-λ5-jodán | ||
| Más nevek | jód-fluorid | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 7783-66-6 | ||
| PubChem | 522683 | ||
| ChemSpider | 455940 | ||
| EINECS-szám | 232-019-7 | ||
| |||
| |||
| InChIKey | PJIYEPACCBMRLZ-UHFFFAOYSA-N | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | IF5 | ||
| Moláris tömeg | 221,89 g/mol | ||
| Megjelenés | színtelen vagy halványsárga folyadék | ||
| Sűrűség | 3,250 g/cm³ | ||
| Olvadáspont | 9,43 °C | ||
| Forráspont | 97,85 °C | ||
| Oldhatóság (vízben) | hidrolizál[1] | ||
| Kristályszerkezet | |||
| Kristályszerkezet | monoklin point group C2/c | ||
| Koordinációs geometria |
négyzetes piramis | ||
| Molekulaforma | négyzetes piramis[2] | ||
| Veszélyek | |||
| MSDS | External MSDS | ||
| Főbb veszélyek | mérgező, oxidáló hatású, korrozív. | ||
| NFPA 704 | |||
| Rokon vegyületek | |||
| Azonos kation | jód-pentoxid | ||
| Azonos anion | bróm-pentafluorid | ||
| Rokon vegyületek | jód-monofluorid jód-trifluorid jód-heptafluorid | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A jód-pentafluorid interhalogén vegyület, képlete IF5. Szobahőmérsékleten színtelen vagy sárga folyadék, sűrűsége 3,250 g cm−3. Elsőként Henri Moissan szintetizálta 1891-ben, szilárd jód fluorgázban történő égetésével.[4] Ez a reakció exoterm és még ma is használják jód-pentafluorid előállításához, bár a reakció körülményein azóta javítottak.[5][6]
I2 + 5 F2 → 2 IF5
A jód-pentafluorid erős fluorozó és oxidáló szer. A vízzel hevesen reagál, hidrogén-fluoridot és jód-heptafluoridot képez. Primer aminokkal való reakciója során – hidrolízist követően – nitril keletkezik.[7]
- R-CH2-NH2 → R-CN
Fordítás szerkesztés
Ez a szócikk részben vagy egészben az Iodine pentafluoride című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források szerkesztés
- ↑ Patnaik, P.. Handbook of Inorganic Chemicals. McGraw-Hill (2002). ISBN 0-07-049439-8
- ↑ Durbank, R. D.; Jones, G. R. (1974). „Crystal structure of Iodine Pentafluoride at -80° ”. Inorganic Chemistry 13 (5), 421–439. o. DOI:10.1021/ic50135a012.
- ↑ a b http://www.chemadvisor.com/Matheson/database/msds/mat11440000800003.PDF
- ↑ Moissan, M. H. (1891). „Nouvelles Recherches sur le Fluor”. Annales de Chimie et de Physique 6 (24), 224–282. o.
- ↑ (1930) „Das Jod-7-fluorid [The iodine-7-fluoride]” (német nyelven). Zeitschrift für Anorganische und Allgemeine Chemie 193 (1), 176–186. o. DOI:10.1002/zaac.19301930117.
- ↑ Ruff O.; Keim R. (1931). „Fluorierung von Verbindungen des Kohlenstoffs (Benzol und Tetrachlormethan mit Jod-5-fluorid, sowie Tetrachlormethan mit Fluor) [Fluoridation of Carbon Compounds (Benzene and Tetrachlormethane with Iodine-5-Fluoride, and Tetrachloromethane with Fluorine)]” (német nyelven). Zeitschrift für Anorganische und Allgemeine Chemie 201 (1), 245–258. o. DOI:10.1002/zaac.19312010122.
- ↑ Stevens, T. E. (1966). „Rearrangement of Amides with Iodine Pentafluoride”. Journal of Organic Chemistry 31 (6), 2025–2026. o. DOI:10.1021/jo01344a539.
