Arzénessav
| Arzénessav | |||

| |||
| |||
| IUPAC-név | arzénessav | ||
| Más nevek | Arzénessav Arzénesoxid | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 13464-58-9 | ||
| PubChem | 545 | ||
| ChemSpider | 530 | ||
| DrugBank | DB04456 | ||
| ChEBI | 49900 | ||
| |||
| |||
| InChIKey | GCPXMJHSNVMWNM-UHFFFAOYSA-N | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | H3AsO3 | ||
| Moláris tömeg | 125,94 g/mol | ||
| Megjelenés | Csak vizes oldatokban létezik | ||
| Mágneses szuszceptibilitás | -51.2·10−6 cm³/mol | ||
| Veszélyek | |||
| Főbb veszélyek | Mérgező, korridál | ||
| PEL | [1910,1018] TWA 0,010 mg/m³[1] | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
Az arzénessav egy szervetlen vegyület, melynek képlete H3AsO3. Vizes oldatokban fordul elő, külön anyagként még nem sikerült izolálni. Ez azonban semmit nem von le az As(OH)3 jelentőségéből.[2]
Jellemzői
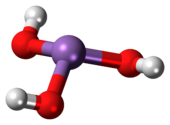
szerkesztésAz As(OH)3 egy piramisos elrendezésű molekula, mely három hidroxi-csoportot tartalmaz, melyek mind egy arzénhoz kapcsolódnak. Az 1H mágneses magrezonanciaspektrum egy jelből áll, mely összhangban van a molekula magas szintű szimmetriájával.[3] Ezzel ellentétben a nominálisan ide kapcsolódó foszforos elemek, mint a H3PO3 leginkább a HPO(OH)2 struktúráját veszik fel. Az arzénos és a foszforos vegyületek viselkedése közti különbség azzal magyarázható, hogy a magasabb oxidációs állapotok egy csoporton belül annál stabilabbak, minél kisebb a tömegük.[4]
Egyes esetekben amfoter anyag, például sósavval, hidrogén-bromiddal, hidrogén-jodiddal megfordíthatóan reagál arzén-trikloridot, arzén-tribromidot és arzén-trijodidot képezve.
As(OH)3(aq) + 3HCl(aq) ⇔ AsCl3(aq) + 3H2O(l)
As(OH)3(aq) + 3HBr(aq) ⇔ AsBr3(aq) + 3H2O(l)
As(OH)3(aq) + 3HI(aq) ⇔ AsI3(aq) + 3H2O(l)
Reakciói
szerkesztésAz As(OH)3 előállításához az arzén-trioxid vízben való hidrolízisére van szükség. Bázis hozzáadásával az arzénessav arzenitionokká alakul át. [AsO(OH)2]−, [AsO2(OH)]2−, és [AsO3]3−. Az első pKa 9,2, As(OH)3 egy gyenge sav.[4] Az arzén-trioxid vizes reakciói az arzénessav és annak konjugált bázisainak tudhatóak be.
Toxikológia
szerkesztésAz arzéntartalmú vegyületek nagyon mérgezőek és karcinogének. Az arzénessav vízmentes változata, az arzén-trioxid megtalálható növényvédő szerekben és különféle gyógyszerekben.
Jegyzetek
szerkesztés- ↑ a b c NIOSH Pocket Guide to Chemical Hazards #0038. National Institute for Occupational Safety and Health (NIOSH)
- ↑ Munoz-Hernandez, M.-A..szerk.: King, R. B.: Arsenic: Inorganic Chemistry, Encyclopedia of Inorganic Chemistry. Chichester: John Wiley & Sons (1994)
- ↑ (2008) „A pH-Metric, UV, NMR, and X-ray Crystallographic Study on Arsenous Acid Reacting with Dithioerythritol” (pdf). Inorganic Chemistry 47, 3832–3840. o. [2012. április 25-i dátummal az eredetiből archiválva]. DOI:10.1021/ic7024439. PMID 18380458. (Hozzáférés: 2011. december 18.)
- ↑ a b Chemistry of the Elements, 2nd, Butterworth-Heinemann (1997). ISBN 0-08-037941-9
Források
szerkesztés- Arsenic trioxide. (Hozzáférés: 2006. január 29.)