Hem a
| Hem a | |||
 |
| ||
| Más nevek | Vas-citoporfirin IX, formilporfirin | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 18535-39-2 | ||
| PubChem | 5288529 | ||
| ChemSpider | 21106444 | ||
| MeSH | Heme+a | ||
| |||
| |||
| InChIKey | RRRJRRNGYOECDS-ZHOBENDVSA-L | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C49H56FeN4O6 | ||
| Moláris tömeg | 852,84 g/mol | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
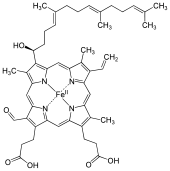
A hem a hem, porfinból álló, vassal kelátot képző koordinációs komplex. A hem a biomolekula, és számos élőlény előállítja. Oldatban gyakran dikroizmust mutat – zöld vagy vörös. A hemoglobint alkotó hem b-hez hasonló szerkezetű.
Kapcsolata más hemekkel
szerkesztésA hem a a hem b-től a 8. helyzetű metilcsoport helyén lévő formilcsoportban és a hidroxietilfarnezilcsoportban tér el, mely a 2. helyzetű atom vinil oldalláncához csatlakozik. Hasonlít továbbá a hem o-hoz a 2. helyzetű farnezilcsoportban, de a hem O-n nem formil-, hanem metilcsoport van. A hem a szerkezetét a redukált (Fe(II)) hemen végzett NMR- és IR-kísérletek alapján 1975-ben határozták meg.[1] Ezt a vasmentes változat dimetil-észterének előállításával erősítették meg.[2]
Története
szerkesztésA hem a-t először a német Otto Heinrich Warburg izolálta 1951-ben, ő mutatta ki, hogy a citokróm c-oxidáz aktív komponense a hem a.[3]
Sztereokémia
szerkesztésA hidroxilcsoporthoz kapcsolódó szén, az I. gyűrű 3. helyzetű atomja királis központ, ennek konfigurációja S.[4]
A hem b-hez hasonlóan a hem a gyakran a vas és egy aminosav oldallánc koordinációs kötésével kapcsolódik az apoproteinhez. A citokróm c-oxidázban a hem az 5. liganduma hisztidin.[5] Ez számos hemoproteinben, például a hemoglobinban és a mioglobinban is jelen van.
Hem a-tartalmú metalloprotein például a citokróm c-oxidáz. E fehérje két helyen tartalmaz hem a-t, ezek funkciója eltér. A citokróm a hem a-jában a vas koordinációs száma 6. A citokróm a3-ban lévő vas néha 5 atomhoz kapcsolódik, lehetővé téve, hogy a hatodik hely kétatomos oxigént kössön meg.[6] Az enzimben továbbá 3 réz-, magnézium-, cink- és néhány kálium- és nátriumion van. A CCO két hem a-ja egymással, a rézzel és a hozzájuk közeli citokróm c-vel könnyen cserélnek elektront.
A formilcsoport és az izoprenoid oldallánc célja feltehetően az energiamegtartás az oxigénredukcióban. A CCO felel az oxigén redukciójáért a mitokondrium membránközi terébe való protonpumpálással. A formil- és a hidroxietilfarnezilcsoportok is feltehetően szerepet játszanak ebben Josikava S. és társai tanulmánya alapján.[7]
Jegyzetek
szerkesztés- ↑ Caughey, W. S. (1975). „Heme A of Cytochrome c Oxidase”. Journal of Biological Chemistry 250 (19), 7602–7622. o. DOI:10.1016/S0021-9258(19)40860-0. PMID 170266.
- ↑ Battersby, Alan R. (1985). „Isolation, crystallisation, and synthesis of the dimethyl ester of porphyrin a, the iron-free prosthetic group of cytochrome c oxidase”. Journal of the Chemical Society, Perkin Transactions 1, 135. o. DOI:10.1039/P19850000135.
- ↑ Warburg, O (1951). „Cytohämin aus Herzmuskel”. Zeitschrift für Physiologische Chemie 288 (1), 1–4. o. DOI:10.1515/bchm2.1951.288.1.1. PMID 14860765.
- ↑ Yamashita E, Aoyama H, Yao M, Muramoto K, Shinzawa-Itoh K, Yoshikawa S, Tsukihara T (2005). „Absolute configuration of the hydroxyfarnesylethyl group of heme A, determined by X-ray structural analysis of bovine heart cytochrome c oxidase using methods applicable at 2.8 Angstrom resolution”. Acta Crystallographica D 61 (10), 1373–1377. o. DOI:10.1107/S0907444905023358. PMID 16204889.
- ↑ Tsukihara T, Shimokata K, Katayama Y, Shimada H, Muramoto K, Aoyama H, Mochizuki M, Shinzawa-Itoh K, Yamashita E, Yao M, Ishimura Y, Yoshikawa S (2003). „The low-spin heme of cytochrome c oxidase as the driving element of the proton-pumping process”. PNAS 100 (26), 15304–15309. o. DOI:10.1073/pnas.2635097100. PMID 14673090. PMC 307562.
- ↑ a b (1998) „Redox-Coupled Crystal Structural Changes in Bovine Heart Cytochrome c Oxidase”. Science 280 (5370), 1723–1729. o. DOI:10.1126/science.280.5370.1723. PMID 9624044.
- ↑ Shimokata K, Katayama Y, Murayama H, Suematsu M, Tsukihara T, Muramoto K, Aoyama H, Yoshikawa S, Shimada H (2007). „The proton pumping pathway of bovine heart cytochrome c oxidase”. PNAS 104 (10), 4200–4205. o. DOI:10.1073/pnas.0611627104. PMID 17360500. PMC 1820732.
Fordítás
szerkesztésEz a szócikk részben vagy egészben a Heme A című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.