Tiirán
| Tiirán | |||
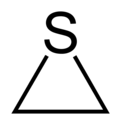 A tiirán szerkezeti képlete |
 A tiirán kalotta-modellje | ||
 A tiirán pálcikamodellje | |||
| Szabályos név | tiirán[1] | ||
| Más nevek | 2,3-dihidrotiirén[1] | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 420-12-2 | ||
| PubChem | 9865 | ||
| ChemSpider | 9481 | ||
| EINECS-szám | 206-993-9 | ||
| KEGG | C19419 | ||
| MeSH | ethylene+sulfide | ||
| ChEBI | 30977 | ||
| RTECS szám | KX3500000 | ||
| |||
| InChIKey | VOVUARRWDCVURC-UHFFFAOYSA-N | ||
| Beilstein | 102379 | ||
| Gmelin | 1278 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C2H4S | ||
| Moláris tömeg | 60,12 g/mol | ||
| Megjelenés | halványsárga folyadék | ||
| Sűrűség | 1,01 g cm−3 | ||
| Olvadáspont | −109 °C | ||
| Forráspont | 55,85 °C | ||
| Gőznyomás | 28,6 kPa (20 °C-on) | ||
| Termokémia | |||
| Std. képződési entalpia ΔfH |
51–53 kJ mol-1 | ||
| Égés standard- entalpiája ΔcH |
−2,0126 MJ mol-1 | ||
| Veszélyek | |||
| EU osztályozás | |||
| NFPA 704 | |||
| R mondatok | R11, R23/25, R41 | ||
| S mondatok | S16, S36/37/39, S45 | ||
| Lobbanáspont | 10 °C | ||
| Rokon vegyületek | |||
| Rokon heterociklusok | etilén-oxid aziridin borirán | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A tiirán vagy ismertebb nevén etilén-szulfid gyűrűs szerves vegyület, képlete C2H4S.[2] A legkisebb kéntartalmú heterociklus. Sok más kéntartalmú szerves vegyülethez hasonlóan ez az anyag is kellemetlen szagú. Az etilén-szulfid származékait is szokták összefoglaló néven tiiránoknak nevezni.
Előállítása
szerkesztésEtilén-karbonát és kálium-tiocianát reakciójával állítják elő.[3] A KSCN-t először vákuum alatt megolvasztják, hogy a víztartalma eltávozzon.
- KSCN + C2H4O2CO → KOCN + C2H4S + CO2
Reakciói
szerkesztésAz etilén-szulfid aminokra addícionálva 2-merkaptoetilaminokká alakul,[4] melyek jó kelátképző ligandumok.
- C2H4S + R2NH → R2NCH2CH2SH
Fordítás
szerkesztésEz a szócikk részben vagy egészben a Thiirane című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Hivatkozások
szerkesztés- ↑ a b c d thiirane (CHEBI:30977). Chemical Entities of Biological Interest (ChEBI). European Bioinformatics Institute
- ↑ Warren Chew; David N. Harpp (1993). „Recent aspects of thiirane chemistry”. Journal of Sulfur Chemistry 15 (1), 1–39. o. DOI:10.1080/01961779308050628.
- ↑ Searles, S.; Lutz, E. F.; Hays, H. R.; Mortensen, H. E. "Ethylenesulfide" Organic Syntheses, 1973, Collective Volume 5, page 562.
- ↑ R. J. Cremlyn “An Introduction to Organosulfur Chemistry” John Wiley and Sons: Chichester (1996). ISBN 0-471-95512-4.
