Trifluorecetsav
A trifluorecetsav egy szerves fluorvegyület, összegképlete CF3CO2H. A trifluorecetsav egy ecetsav analóg, melyben a metilcsoport három hidrogénjét fluoratomok helyettesítik. Standard körülmények közt színtelen folyadék, erős, ecetre emlékeztető szaggal. Az ecetsavnál körülbelül 34000-szer erősebb sav a trifluormetil-csoport nagy elektronvonzó képességének köszönhetően. A trifluorecetsavat széles körben alkalmazzák szerves szintézisekben különböző célokra.
| Trifluorecetsav | |||
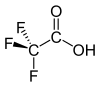 2 dimenziós szerkezet |
 3 dimenziós szerkezet | ||

| |||
| Kémiai azonosítók | |||
| CAS-szám | 76-05-1 | ||
| PubChem | 6422 | ||
| ChemSpider | 10239201 | ||
| ChEBI | 45892 | ||
| RTECS szám | AJ9625000 | ||
| |||
| |||
| InChIKey | DTQVDTLACAAQTR-UHFFFAOYSA-N | ||
| UNII | E5R8Z4G708 | ||
| ChEMBL | 506259 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C2HF3O2 | ||
| Moláris tömeg | 114.02 g/mol | ||
| Megjelenés | színtelen folyadék | ||
| Sűrűség | 1.489 g/cm³, 20 °C | ||
| Olvadáspont | -15,4 °C | ||
| Forráspont | 72,4 °C | ||
| Oldhatóság (vízben) | korlátlanul elegyedik | ||
| Savasság (pKa) | 0.23[1] | ||
| Mágneses szuszceptibilitás | -43.3·10−6 cm³/mol | ||
| Veszélyek | |||
| Főbb veszélyek | Korrozív | ||
| NFPA 704 | |||
| R mondatok | R20 R35 R52/53 | ||
| S mondatok | S9 S26 S27 S28 S45 S61 | ||
| Az infoboxban SI-mértékegységek szerepelnek. Ahol lehetséges, az adatok standardállapotra (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. Az ezektől való eltérést egyértelműen jelezzük. | |||
Előállítás
szerkesztésA trifluorecetsavat iparilag az acetil-klorid vagy ecetsav-anhidrid elektrofluorozásával, majd az így keletkező trifluoracetil-fluorid hidrolízisével állítják elő:[2]
- CH3COCl + 4 HF → CF3COF + 3 H2 + HCl
- CF3COF + H2O → CF3COOH + HF
Ha szükséges a terméket trifluorecetsav-anhidrid hozzáadásával lehet szárítani.[3]
A trifluorecetsav kis koncentrációban (<200 ng/L) a tengervízben is megtalálható.[4][5]
Felhasználás
szerkesztésA trifluorecetsav több szerves fluorvegyület - például a trifluorecetsav-anhidrid, a trifluorperecetsav és a 2,2,2-trifluoretanol prekurzora.[2] Szerves szintézisekben reagensként használják az olyan kedvező tulajdonságai miatt, mint az illékonyság, szerves oldószerekben való oldhatóság és nagy saverősség.[6] A trifluorecetsav kevésbé oxidáló hatású mint a kénsav és könnyebben elérhető vízmentes formában, mint a legtöbb másik sav. Használatát megnehezíti, hogy vízzel azeotrópos elegyet alkot (fp. 105 °C).
A trifluorecetsavat elterjedten alkalmazzák szerves szintézisekben a terc-butoxikarbonil védőcsoport eltávolítására.[7][8]
Emellett használják még trifluoracetát-sók előállítására is.[9]
Források
szerkesztés- ↑ Ref 1 in (1981) „Dissociation constant of aqueous trifluoroacetic acid by cryoscopy and conductivity”. Journal of Solution Chemistry 10 (7), 479. o. DOI:10.1007/BF00652082.
- ↑ a b Ullmann Vegyipari Enciklopédia
- ↑ Chapter 4 - Purification of Organic Chemicals, Purification of Laboratory Chemicals, 6th. DOI: 10.1016/B978-1-85617-567-8.50012-3
- ↑ (2002. január 1.) „Trifluoroacetate in ocean waters”. Environ. Sci. Technol. 36 (1), 12–5. o. DOI:10.1021/es0221659. PMID 11811478.
- ↑ (2005. szeptember 1.) „Trifluoroacetate profiles in the Arctic, Atlantic, and Pacific Oceans”. Environ. Sci. Technol. 39 (17), 6555–60. o. DOI:10.1021/es047975u. PMID 16190212.
- ↑ szerk.: L. Paquette: {{{title}}}, Encyclopedia of Reagents for Organic Synthesis. New York: J. Wiley & Sons. DOI: 10.1002/047084289 (2004)
- ↑ (1978) „Removal of t-Butyl and t-Butoxycarbonyl Protecting Groups with Trifluoroacetic acid”. International Journal of Peptide and Protein Research 12 (5), 258–268. o. DOI:10.1111/j.1399-3011.1978.tb02896.x. PMID 744685.
- ↑ Andrew B. Hughes. 1. Protection Reactions, Amino Acids, Peptides and Proteins in Organic Chemistry: Protection Reactions, Medicinal Chemistry, Combinatorial Synthesis. DOI: 10.1002/9783527631827.ch1
- ↑ (2003) „High quality YBa2Cu3O7 thin films grown by trifluoroacetates metal-organic deposition”. Superconductor Science and Technology 16 (1), 45–53. o. DOI:10.1088/0953-2048/16/1/309.
Fordítás
szerkesztésEz a szócikk részben vagy egészben a Trifluoroacetic acid című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
