Bróm-pentafluorid
| bróm-pentafluorid | |||
 A bróm-pentafluorid szerkezete és dimenziói gázfázisban | |||
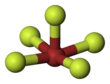 A bróm-pentafluorid pálcikamodellje |
 A bróm-pentafluorid kalottamodellje | ||
| IUPAC-név | bróm-pentafluorid | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 7789-30-2 | ||
| PubChem | 24606 | ||
| ChemSpider | 23008 | ||
| RTECS szám | EF9350000 | ||
| |||
| |||
| InChIKey | XHVUVQAANZKEKF-UHFFFAOYSA-N | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | BrF5 | ||
| Moláris tömeg | 174,894 g·mol−1 | ||
| Megjelenés | halványsárga folyadék | ||
| Sűrűség | 2,466 g/cm³ | ||
| Olvadáspont | −61,30 °C | ||
| Forráspont | 40,25 °C | ||
| Oldhatóság (vízben) | reagál | ||
| Kristályszerkezet | |||
| Molekulaforma | négyzetes piramisos | ||
| Veszélyek | |||
| MSDS | External MSDS | ||
| NFPA 704 | |||
| R/S mondatok | R8 R23/24/25 R34 S45 S36/37/39 | ||
| Lobbanáspont | nem gyúlékony | ||
| Rokon vegyületek | |||
| Azonos kation | bróm-monoklorid | ||
| Azonos anion | klór-pentafluorid jód-pentafluorid | ||
| Rokon interhalogének | bróm-monofluorid bróm-trifluorid | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A bróm-pentafluorid interhalogén vegyület, képlete BrF5. Erős fluorozószer, olvadáspontja −61,3 °C, forráspontja 40,25 °C. Az oxigén izotóp-összetételének elemzésben használják: a szilárd szilikátok bróm-pentafluorid jelenlétében végzett lézeres ablációja során O2 gáz szabadul fel, melyet utána analizálnak.[1] Az uránfeldolgozásban fluorozószerként alkalmazzák, valamint vizsgálják, hogy lehet-e használni rakétákban folyékony oxidálószerként.
Előállítás
szerkesztésBróm-pentafluoridot először 1931-ben állították elő bróm és fluor közvetlen reakciójával.[2] Ez a reakció nagy mennyiségű termék gyártására alkalmas, 150 °C feletti hőmérsékleten, fluorfeleslegben hajtják végre:
Br2 + 5 F2 → 2 BrF5
Kis mennyiség előállításához kálium-bromidot és fluort reagáltatnak egymással:[2]
KBr + 3 F2 → KF + BrF5
Az ezzel az eljárással gyártott bróm-pentafluorid szinte teljesen mentes a bróm-trifluoridtól és egyéb szennyeződésektől.[2]
Reakciók
szerkesztésVízzel robbanásszerűen reagál, de acetonitrillel hígítva egyszerű hidrolízistermékek, brómsav és hidrogén-fluorid keletkezik:[3]
BrF5 + 3 H2O → HBrO3 + 5 HF
Rendkívül erős fluorozószer, a legtöbb uránvegyületet már szobahőmérsékleten urán-hexafluoriddá alakítja.
Veszélyek
szerkesztésA bróm-pentafluorid súlyosan maró hatású, gőzei irritálják a szemet, a bőrt és a nyálkahártyát. 100 ppm bróm-pentafluoridnak történő pár perces kitettség halálos a legtöbb kísérleti állat számára. Az anyaggal történő krónikus érintkezés nefrózist és hepatózist okozhat.[4]
Szerves anyagokkal vagy por alakú fémekkel érintkezve azokat spontán meggyújthatja, de akár robbanás is bekövetkezhet.[4]
Fordítás
szerkesztésEz a szócikk részben vagy egészben a Bromine pentafluoride című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források
szerkesztés- ↑ (1963) „The use of bromine pentafluoride in the extraction of oxygen from oxides and silicates for isotopic analysis”. Geochimica et Cosmochimica Acta 27 (1), 43–48. o. DOI:10.1016/0016-7037(63)90071-1.
- ↑ a b c (1968) „Synthesis routes to chlorine and bromine pentafluorides”. Inorganic Chemistry 7 (12), 2648–2649. o. DOI:10.1021/ic50070a039.
- ↑ Greenwood, N.N.. Az elemek kémiája, 1., Budapest: Nemzeti Tankönyvkiadó, 1136. o. (1999). ISBN 963-18-9144-5
- ↑ a b A comprehensive guide to the hazardous properties of chemical substances, 3rd, Wiley-Interscience, 480. o. (2007). ISBN 0-471-71458-5
