Cianogén-klorid
| Cianogén-klorid[1] | |||
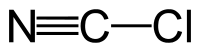
| |||

| |||
| Más nevek | klór-cián | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| Rövidítés | CK | ||
| CAS-szám | 506-77-4 | ||
| PubChem | 10477 | ||
| ChemSpider | 10045 | ||
| EINECS-szám | 208-052-8 | ||
| MeSH | cyanogen+chloride | ||
| RTECS szám | GT2275000 | ||
| |||
| InChIKey | QPJDMGCKMHUXFD-UHFFFAOYSA-N | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | CClN | ||
| Moláris tömeg | 61,47 g/mol | ||
| Megjelenés | Színtelen gáz. | ||
| Sűrűség | 2,7683 mg·ml−1 (0 °C, 101,325 kPa) | ||
| Olvadáspont | −6 °C | ||
| Forráspont | 13 °C | ||
| Gőznyomás | 1,987 MPa (21,1 °C) | ||
| Termokémia | |||
| Std. képződési entalpia ΔfH |
137,95 kJ·mol−1 | ||
| Standard moláris entrópia S |
236,33 J·K−1·mol−1 | ||
| Veszélyek | |||
| MSDS | Inchem | ||
| Főbb veszélyek | Erősen mérgező (T+)[2] | ||
| NFPA 704 | |||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A cianogén-klorid vagy klór-cián szervetlen vegyület, képlete NCCl. Lineáris, három atomból álló pszeudohalogén, könnyen cseppfolyósítható színtelen gáz. A laboratóriumokban sokkal általánosabb a rokon vegyülete, a cianogén-bromid, amelyet széles körben használnak biokémiai analízishez és előkészítéshez.
Szintézise, tulajdonságai, szerkezete
szerkesztésHabár a képlete CNCl formában is használatos, a cianogén-klorid molekulában az atomok kapcsolódási sorrendje: ClCN. A szén- és a klóratomok között egyszeres, a szén- és a nitrogénatomok között hármas kötés van. A rokon cián-halogenidekhez (NCF, NCBr, NCI) hasonlóan lineáris molekula. A cianogén-klorid nátrium-cianid klórral történő oxidációjával állítható elő. Ezen reakció közbülső terméke a dicián ((CN)2).[3]
- NaCN + Cl2 → ClCN + NaCl
A vegyület sav jelenlétében trimerizálódik, heterociklusos cianur-kloridot alkotva.
A cianogén-klorid vízzel lassan hidrolizál, semleges pH-n cianát és kloridion keletkezik:
- ClCN + H2O → Cl− + OCN− + 2 H+
Szintézisének alkalmazása
szerkesztésA cianogén-klorid a szulfonil-cianidok,[4] valamint a klórszulfonil-izocianát prekuzora;[5] utóbbi a szerves szintézisben használt egyik hasznos reagens.
Biztonság
szerkesztésA cianogén-klorid, más elnevezéssel CK, rendkívül mérgező vérméreg, amelyet vegyi fegyverként való felhasználásra is javasoltak. Szemmel, vagy légzőszervekkel való érintkezés esetén azonnal sérülést okoz. A vegyi anyagnak való kitettség tünetei lehetnek: aluszékonyság, orrfolyás, torokfájás, köhögés, zavartság, hányinger, hányás, ödéma, eszméletvesztés, görcsök, bénulás és halál.[2] Különösen azért veszélyes, mert amerikai elemzők szerint képes áthatolni a gázálarc szűrőin. A CK a polimerizációra való hajlandósága miatt instabil, ez akár robbanásszerű hevességgel is végbemehet.[6]
A cianogén-klorid a Vegyifegyver-tilalmi Egyezmény I. Mellékletének 3. listáján szerepel, mint mérgező vegyület. Gyártását és az Egyezmény Részes Államai közti exportját és importját jelenteni kell az adott államban kijelölt nemzeti hatóságon keresztül a Vegyifegyver-tilalmi Szervezetnek (OPCW). Magyarországon a kijelölt nemzeti hatóság a Magyar Kereskedelmi Engedélyezési Hivatal.[7]
Fordítás
szerkesztésEz a szócikk részben vagy egészben a Cyanogen chloride című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források
szerkesztés- ↑ CRC Handbook of Chemistry and Physics, 87th, Boca Raton, FL: CRC Press (2006. október 1.). ISBN 0-8493-0487-3
- ↑ a b CYANOGEN CHLORIDE (CK). The Emergency Response Safety and Health Database. NIOSH
- ↑ Coleman, G. H.; Leeper, R. W.; Schulze, C. C. (1946). „Cyanogen Chloride”. Inorganic Syntheses 2, 90–94. o. DOI:10.1002/9780470132333.ch25.
- ↑ Vrijland, M. S. A. (1977). „Sulfonyl Cyanides: Methanesulfonyl Cyanide”. Org. Synth. 57, 88. o. ; Coll. Vol. 6: 727
- ↑ Graf, R. (1966). „Chlorosulfonyl Isocyanate”. Org. Synth. 46, 23. o. ; Coll. Vol. 5: 226
- ↑ FM 3-8 Chemical Reference Handbook. US Army (1967)
- ↑ http://mkeh.gov.hu/haditechnika/vegyifegyver_tilalmi
Külső hivatkozások
szerkesztés- Murphy-Lavoie, H.: Cyanogen Chloride Poisoning. eMedicine. MedScape, 2011
- National Pollutant Inventory – Cyanide compounds fact sheet. Australian Government
