Diazóniumvegyületek
A diazóniumvegyületek vagy diazóniumsók olyan szerves vegyületek, melyekben R−N+2X– funkciós csoport található, ahol R alkil- vagy arilcsoport, X pedig szerves vagy szervetlen anion, például halogenid. A diazóniumsók – különösen, amelyekben R aromás csoport – az azoszínezékek előállításának fontos köztitermékei.[1]
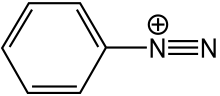
Előállításuk
szerkesztésA diazóniumsók előállítását „diazotálásnak” nevezzük, e reakcióról elsőként Peter Griess számolt be 1858-ban, és később ezen új vegyületcsalád több reakcióját is felfedezte. A diazóniumsók előállításának legfontosabb módszere aromás aminok salétromossavval és másik savval történő reagáltatása. A salétromossavat többnyire in situ (ugyanabban a lombikban) állítják elő nátrium-nitrit és ásványi sav (általában HCl, H2SO4 vagy HBF4) feleslegének reakciójával:
- ArNH2 + HNO2 + H+ → ArN+2 + 2H2O
Vizes oldatban a hagyományosan anilinből előállított diazónium-klorid sók +5 °C felett instabilak, azonban a diazóniumvegyületeket tetrafluoroborát vagy tozilát só formájában izolálni lehet,[2] ezek szobahőmérsékleten is stabil szilárd anyagok. Általában előnyös, ha a diazóniumsó oldatban marad, de az oldat hajlamos a túltelítődésre. A kezelőszemélyzet több tagja is meghalt vagy megsérült egy balesetben, melyet a váratlanul kikristályosodó só robbanása okozott.[3]
Ezen veszélyek miatt a diazóniumvegyületeket általában nem izolálják, előállításuk után további reakcióban azonnal felhasználják őket. Erre az eljárásra példa az alábbi arilszulfonil vegyület előállítása:[4]
Azokapcsolás
szerkesztésA legelterjedtebben használt reakció az azokapcsolás. Ebben a folyamatban a diazóniumsó egy elektronban gazdag szubsztráttal reagál. Ha a reakciópartner aromás vegyület, például anilin- vagy fenolszármazék, akkor a reakció mechanizmusa aromás elektrofil szubsztitúció:
- ArN+2 + Ar′H → ArN2Ar′ + H+
A kapcsolási reakciók másik kereskedelmileg fontos reagensei az acetecetamidok, ezt illusztrálja a Pigment Yellow 12 nevű diarilid színezék előállítása.[5]
A kapott azovegyületek gyakran hasznos színezékek, ezek az úgynevezett azoszínezékek.[6] Mély színük a kiterjedt konjugációt tükrözik. Például az úgynevezett anilinsárga festéket anilin és hideg diazóniumsó oldatának összekeverésével, majd erőteljes rázásával állítják elő. Az anilinsárga sárga szilárd anyagként válik ki.[7] Hasonlóképpen a naftalin-2-ol (Β-naftol) hideg lúgos oldatával intenzív narancsvörös csapadék keletkezik.[7] A metilnarancs olyan azofesték, amelyet a laboratóriumban pH indikátorként alkalmaznak.
A N2 csoport helyettesítése
szerkesztésAz aromás diazónium kationok több olyan reakcióban is részt vesznek, amelyben a N2 csoport helyébe más csoport vagy ion lép. Ezek közül néhány jelentősebbet alább ismertetünk.[8][9]
Helyettesítés halogénnel
szerkesztésSandmeyer-reakció
szerkesztésA benzoldiazónium-klorid HCl-ben, illetve HBr-ben oldott réz(I)-kloriddal, illetve réz(I)-bromiddal melegítve klórbenzolt, illetve brómbenzolt eredményez.
- C6H5N+2 + CuCl → C6H5Cl + N2 + Cu+
Gatterman-reakció
szerkesztésA Gatterman-reakció során a benzoldiazónium-kloridot rézporral és HCl-lel vagy HBr-rel melegítve klórbenzol, illetve brómbenzol keletkezik. A reakciót Ludwig Gattermann német kémikusról nevezték el.[10]
- C6H5N+2 + Cu → C6H5X + N2 + Cu+
Jodidra cserélés
szerkesztésA benzolgyűrűre jódot nehéz közvetlenül bevinni, aromás diazónium kationok kálium-jodiddal történő kezelésével azonban ez kivitelezhető:
- C6H5N+2 + KI → C6H5I + K+ + N2
Fluoridra cserélés
szerkesztésA fluorbenzolt benzoldiazónium-fluoroborát hőbontásával állítják elő, ez az úgynevezett Schiemann-reakció.[11]
- [C6H5N+2]BF−4 → C6H5F + BF3 + N2
További cserereakciók
szerkesztésHidrogénre cserélés
szerkesztésAz aromás diazónium kationok hipofoszforossavval vagy nátrium-sztannittal redukálva benzolt adnak:
- [C6H5N+2]Cl− + H3PO2 + H2O → C6H6 + N2 + H3PO3 + HCl
Hidroxilcsoportra cserélés
szerkesztésAz arildiazóniumsók vizes oldatának 100 °C-ra melegítésével fenolok állíthatók elő.
- C6H5N+2 + H2O → C6H5OH + N2 + H+
Ezt a reakciót elfőzésnek is nevezik. A képződő fenol reagálhat a diazóniumsóval, ezért a reakciót sav jelenlétében végzik, amely segít visszaszorítani ezt a további reakciót.
Nitrocsoport bevitele
szerkesztésBenzoldiazónium-fluoroborát nátrium-nitrites kezelésével réz jelenlétében nitrobenzol nyerhető. Alternatív megoldásként az anilin diazotálását réz(I)-oxid jelenlétében végezve in situ keletkezik réz(I)-nitrit:
- C6H5N+2 + CuNO2 → C6H5NO2 + N2 + Cu+
Cianocsoport bevitele
szerkesztésHalogénezett aromás vegyületekbe nukleofil szubsztitúcióval a cianocsoport általában nem vihető be, de az ilyen vegyületek könnyen előállíthatók diazóniumsókból. Ilyen például a benzonitril előállítása réz(I)-cianid reagenssel:
- C6H5N+2 + CuCN → C6H5CN + Cu+ + N2
Ez a reakció a Sandmeyer-reakció egyik speciális változata.
Tiolcsoport bevitele
szerkesztésA diazóniumsók két lépésben tiolokká alakíthatóak. Benzoldiazónium-klorid kálium-etilxantátos kezelésével, majd az így kapott xantát észter köztitermék hidrolízisével tiofenol keletkezik:
- C6H5N+2 + C2H5OCS−2 → C6H5SC(S)OC2H5
- C6H5SC(S)OC2H5 + H2O → C6H5SH + HOC(S)OC2H5
Arilcsoport bevitele
szerkesztésArilcsoportokat is össze lehet kapcsolni az arildiazónium sók felhasználásával. A benzoldiazónim-kloridot nátrium-hidroxid jelenlétében benzollal (egy aromás vegyülettel) reagáltatva például bifenil keletkezik:
- [C6H5N+2]Cl− + C6H6 → C6H5−C6H5 + N2 + HCl
Ez a reakció Gomberg–Bachmann reakció néven ismert. Hasonló átalakítás érhető el benzoldiazónium-klorid etanollal és rézporral történő kezelésével.
Karboxilcsoport bevitele
szerkesztésA diazónium-fluoroborátok alifás karbonsavval reagálva a megfelelő benzoesavat eredményezik. Ezzel a reakcióval alifás karbonsavakból lehet aromás karbonsavat előállítani:[forrás?]
- [C6H5N+2]BF−4 + RCO2H → C6H5CO2H + BF3 + N2 + RF
Meerwein-reakció
szerkesztésA benzoldiazónium-klorid aktivált kettős kötéseket tartalmazó vegyületekkel fenilezett termékeket ad. A reakció az úgynevezett Meerwein-reakció vagy Meerwein-arilezés:
- [C6H5N+2]Cl− + ArCH=CHCO2H → ArC=C−C6H5 + N2 + CO2 + HCl
Fémkomplexek
szerkesztésA fémkomplexekkel végbemenő reakciókban a diazónium kationok a NO+-hoz hasonlóan viselkednek. Az alacsony oxidációs állapotú fémkomplexek például a diazónium sókkal addíciós reakcióba lépnek. Jellemző komplexek a [Fe(CO)2(PPh3)2(N2Ph)]+ és a királis fémcentrumú Fe(CO)(NO)(PPh3)(N2Ph).[12]
Hidrazincsoporttá történő redukció
szerkesztésA diazóniumsók ón(II)-kloriddal (SnCl2) a megfelelő hidrazinszármazékká redukálhatóak. Ez a reakció különösen a triptán vegyületek és az indometacin Fischer-féle indolszintézisében előnyös. Redukálószerként az ón(II)-klorid helyett előnyösebben nátrium-ditionit is használható, ez részben olcsóbb, és környezetvédelmi szempontból is kedvezőbb.
Biztonságtechnika
szerkesztésA szilárd diazónium-halogenidek többnyire rendkívül robbanásveszélyesek, sérüléssel és halállal járó balesetek is történtek már.
Az anion tulajdonságai befolyásolják a só stabilitását. Aril-diazónium-perklorátokat, például a nitrobenzoldiazónium-perklorátot robbanószerek iniciátoraként alkalmazzák.
Hivatkozások
szerkesztés- ↑ Chemistry of the Diazonium and Diazo Groups: Part 1. S. Patai, Ed. 1978 Wiley-Blackwell. ISBN 0-471-99492-8. Chemistry of the Diazonium and Diazo Groups: Part 2. S. Patai, Ed. 1978 Wiley-Blackwell. ISBN 0-471-99493-6.
- ↑ Filimonov, Victor D. (2008. szeptember 18.). „Unusually Stable, Versatile, and Pure Arenediazonium Tosylates: Their Preparation, Structures, and Synthetic Applicability” (angol nyelven). Organic Letters 10 (18), 3961–3964. o. DOI:10.1021/ol8013528. ISSN 1523-7060.
- ↑ UK CRHF Incident Report - Supersaturated Diazonium salt causes Fatality. [2018. október 6-i dátummal az eredetiből archiválva]. (Hozzáférés: 2010. május 13.)
- ↑ R. V. Hoffman (1981). „m-Trifluoromethylbenzenesulfonyl Chloride”. Org. Synth. 60, 121. o. DOI:10.15227/orgsyn.060.0121.
- ↑ K. Hunger. W. Herbst "Pigments, Organic" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2012. doi:10.1002/14356007.a20_371
- ↑ Klaus Hunger, Peter Mischke, Wolfgang Rieper, et al. "Azo Dyes" in Ullmann’s Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a03_245.
- ↑ a b Clark, Jim: chemguide. (Hozzáférés: 2011. szeptember 28.)
- ↑ March, J. “Advanced Organic Chemistry” 4th Ed. J. Wiley and Sons, 1992: New York. ISBN 978-0-471-60180-7.
- ↑ Marye Anne Fox. Organic Chemistry, 3, illustrated, Jones & Bartlett Learning, 535–538. o. (2004)
- ↑ L. Gattermann (1894). „Untersuchungen über Diazoverbindungen”. Berichte der deutschen chemischen Gesellschaft 23 (1), 1218–1228. o. DOI:10.1002/cber.189002301199.
- ↑ Flood, D. T. (1933). „Fluorobenzene”. Org. Synth. 13, 46. o. DOI:10.15227/orgsyn.013.0046..
- ↑ (1993) „Organometallic Diazo Compounds”. Chem. Rev. 93, 905–1022. o. DOI:10.1021/cr00019a008.
Fordítás
szerkesztés- Ez a szócikk részben vagy egészben a Diazonium compound című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.