Dinitrogén-oxid
| Dinitrogén-oxid | |

| |
| |
| IUPAC-név | dinitrogén-monoxid |
| Más nevek | Kéjgáz |
| Kémiai azonosítók | |
|---|---|
| CAS-szám | 10024-97-2 |
| ATC kód | N01AX13 |
| Kémiai és fizikai tulajdonságok | |
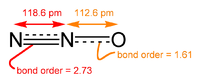
| Kémiai képlet | N2O |
| Moláris tömeg | 44,0128 g/mol |
| Megjelenés | színtelen gáz |
| Sűrűség | 1222,8 kg m−3 (folyadék) 1,8 kg m−3 (gáz) |
| Olvadáspont | −90,86 °C (182,29 K) |
| Forráspont | −88,48 °C (184,67 K) |
| Kristályszerkezet | |
| Dipólusmomentum | 0,166 |
| Veszélyek | |
| EU osztályozás | Oxidatív (O)[1] |
| NFPA 704 | |
| R mondatok | R8[1] |
| S mondatok | S9, S17[1] |
| Rokon vegyületek | |
| Rokon nitrogén-oxidok | Nitrogén-monoxid Dinitrogén-trioxid Nitrogén-dioxid Dinitrogén-tetroxid Dinitrogén-pentoxid |
| Rokon vegyületek | Ammónium-nitrát |
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |
A dinitrogén-oxid (dinitrogén-monoxid, N2O, INN: nitrous oxide) egy színtelen, nem gyúlékony gáz, melynek kellemes édeskés íze és szaga van. A sebészetben és a fogászatban anesztetikus és analgetikus hatását használják. Euforizáló hatása miatt kéjgáznak, vagy nevetőgáznak is nevezik. A belsőégésű motorok üzemanyagához keverve nagyban növeli a motorok teljesítményét oxidáló hatása miatt, ami fokozza az égést. A Föld légkörében jelenlévő dinitrogén-oxid üvegházhatású gáz. A szén-dioxid és a metán után a legjelentősebb üvegházhatású gáz, ami növeli a globális felmelegedést.[2] A köznyelvben és a számítógépes játékokban a dinitrogén-oxidot egyszerűen „nitrónak” nevezik. Könnyen cseppfolyósítható gáz. Oldhatósága vízben és alkoholban jó. Oldódik tömény kénsavban is.
A VIII. Magyar Gyógyszerkönyvben Dinitrogenii oxidum néven hivatalos.
Kémiai tulajdonságai szerkesztés
Önmagában nem gyúlékony, de az égést táplálja. Ennek az az oka, hogy könnyen ad át oxigént. A parázsló fapálcát lángra lobbantja. A dinitrogén-oxid hidrogénnel keverve viszont meggyújtható, meggyújtásakor robban. A reakció során víz és nitrogén keletkezik.
Az ammónia és a dinitrogén-oxid keveréke meggyújtva szintén robban.
Élettani hatása szerkesztés
Az égést táplálja, de a légzést nem, mivel a szervezet nem képes felbontani. Kisebb mennyiségben belélegezve nevetést, mámort, pulzáló hang- és képi hallucinációkat okoz, nagyobb mennyiségben érzéstelenítő és narkotikus hatású. (Innen a kéjgáz név.)
Előállítása szerkesztés
Ammónium-nitrát óvatos hevítésével állítják elő. Ha a hőmérséklet 250 °C fölé emelkedik, a reakció robbanásba mehet át.
Felhasználása szerkesztés
Felhasználják oxigénnel keverve altatógáznak, foghúzások alkalmával érzéstelenítésre. Habszifonokban szén-dioxid helyett használják. Alkalmazzák a méhészetben a kaptárak felnyitásakor a méhek elaltatására is, ekkor ammónium-nitrát tartalmú tabletták hevítésével nyerik. Egyre gyakrabban drogként is feltűnik euforizáló hatása miatt, továbbá belső égésű motorokban a teljesítménynövelés érdekében.
Jegyzetek szerkesztés
- ↑ a b c A dinitrogén-monoxid vegyülethez tartozó bejegyzés az IFA GESTIS adatbázisából. (JavaScript szükséges) (angolul)
- ↑ Új klímafőellenség a láthatáron: vissza kellene fognunk a kéjgáz-kibocsátást. (Hozzáférés: 2020. október 7.)
Források szerkesztés
- Erdey-Grúz Tibor: Vegyszerismeret
