Nitrozóniumion
| Nitrozóniumion | |||
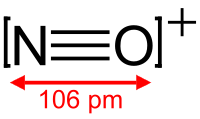 A nitrozóniumion szerkezete | |||
| Szabályos név | iminooxidánium | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| Rövidítés | NO(+) | ||
| CAS-szám | 14452-93-8 | ||
| PubChem | 84878 | ||
| ChemSpider | 76569 | ||
| ChEBI | 29120 | ||
| |||
| |||
| Gmelin | 456 | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A nitrozóniumion NO+ képletű, egyszeresen pozitív töltésű kation, melyben a nitrogénatom hármas kötéssel kapcsolódik az oxigénatomhoz. Ezt az iont rendszerint az alábbi sói formájában nyerik: NOClO4, NOSO4H (nitrozilkénsav, szemléletesebben írva ONSO3OH) és NOBF4. A ClO−4- és a BF−4-sók CH3CN-ben kissé oldódnak. A NOBF4 200–250 °C hőmérsékleten és 0,01 Hgmm nyomáson történő szublimáltatással tisztítható.
A NO+ izoelektronos a CO és N2 molekulákkal. A salétromossav protonálódásával keletkezik:
- HONO + H+ ⇌ NO+ + H2O
Kémiai tulajdonságai
szerkesztésHidrolízis
szerkesztésVízzel készségesen reagálva salétromossavat alkot:
- NOBF4 + H2O → HONO + HBF4
A NOBF4 emiatt víztől, sőt párás levegőtől is védve tárolandó. Bázissal történő reakcióban nitritek keletkeznek:
- NOBF4 + 2 NaOH → NaNO2 + NaBF4 + H2O
Diazotálószer
szerkesztésAromás aminokkal (ArNH2) ArN+2 képletű diazóniumsókat képez. A diazocsoport (az aminocsoporttal ellentétben) számos nukleofillel könnyen helyettesíthető.
Oxidálószerként
szerkesztésA NO+ – pl. NOBF4 formájában – erős oxidálószer:[1]
- ferrocén/ferrocéniummal szemben CH2Cl2 oldatban a [NO]+ redoxipotenciálja 1,00 V (kalomelelektródhoz képest 1,46–1,48 V)
- ferrocén/ferrocéniummal szemben CH3CN oldatban a [NO]+ redoxipotenciálja 0,87 V (kalomelelektródhoz képest 1,27–1,25 V)
A NOBF4 kényelmesen használható oxidálószer, mivel melléktermékként NO gáz keletkezik, mely a reakcióelegyből N2-árammal eltávolítható. Levegővel érintkezve a NO-ból NO2 keletkezik, ami – ha nem távolítják el – másodlagos reakciókat okozhat. A NO2 könnyen észrevehető jellegzetes barnás színéről.
Aromás vegyületek nitrozálása
szerkesztésAz elektronban gazdag aromás vegyületek NOBF4-tal nitrozálhatók.[2] Ilyen például az anilin reakciója:
- CH3OC6H5 + NOBF4 → CH3OC6H4-4-NO + HBF4
NO-komplexek
szerkesztésA NOBF4 egyes fém-karbonil komplexekkel a megfelelő fém-nitrozil komplexek keletkezése közben reagál.[3]
- (C6Et6)Cr(CO)3 + NOBF4 → [(C6Et6)Cr(CO)2(NO)]BF4 + CO
Jegyzetek
szerkesztés- ↑ N. G. Connelly, W. E. Geiger (1996). „Chemical Redox Agents for Organometallic Chemistry”. Chem. Rev. 96 (2), 877–910. o. DOI:10.1021/cr940053x. PMID 11848774.
- ↑ E. Bosch and J. K. Kochi, "Direct Nitrosation of Aromatic Hydrocarbons and Ethers with the Electrophilic Nitrosonium Cation" Journal of Organic Chemistry, 1994, volume 59, pp. 5573–5586.
- ↑ T. W. Hayton, P. Legzdins, W. B. Sharp "Coordination and Organometallic Chemistry of Metal-NO Complexes" Chemical Reviews 2002, volume 102, pp. 935–991
Fordítás
szerkesztésEz a szócikk részben vagy egészben a Nitrosonium című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.