Hajos–Parrish–Eder–Sauer–Wiechert-reakció
| Ezt a szócikket át kellene olvasni, ellenőrizni a szöveg helyesírását és nyelvhelyességét, a tulajdonnevek átírását. Esetleges további megjegyzések a vitalapon. |
A Hajos–Parrish–Eder–Sauer–Wiechert-reakció a szerves kémiában a prolin nevű aminosavval katalizált aszimmetrikus aldol reakció.
Az 1970 körül felfedezett Hajos–Parrish katalitikus eljárásban prokirális szénatomot tartalmazó triketont (1), 0,3 mmol prolin katalizátor segítségével N,N-dimetilformamid (DMF) oldószerben sikerült egy biológiai körülmények között végrehajtott aszimmetriás gyűrűzárásban átalakítani optikailag aktív (a síkban poláros fény polarizációs síkját elforgató) (+)-(3aS,7aS)-3a,4,7,7a-tetrahidro-3a-hidroxi-7a-metil-1,5(6H)-indándionná (+)-2, (100% kitermelés, 93,4% enantiomerfelesleg (ee)).
Ennek az optikailag aktív biciklusos ketolnak a sztereokémiája röntgendiffrakciós vizsgálatok alapján megfelel a digitoxigenin CD-gyűrűje kristályszerkezetének. A (+)-2 ketol savas dehidratálása az optikailag aktív éndionhoz, (+)-(7a,S)-7,7a-dihidro-7a-metil-1,5(6H)-indándionhoz (+)-3 vezet.
Hajos és Parrish nemcsak a 6,5-gyűrűs biciklusos ketolt (+)-2, hanem annak anguláris etil homológját (+)-4 is előállították. A vegyület sztereokémiája röntgendiffrakciós vizsgálatok alapján cisz konfigurációt mutat, de az nem felel meg a digitoxigenin CD-gyűrű kristály szerkezetének. Ennek valószínűleg az etilcsoport és a C-4 és C-6 axiális hidrogének közti 1,3-diaxiális kölcsönhatás az oka. Ez a kölcsönhatás a 7a-etilcsoportot a hattagú gyűrűben ekvatoriális, a 3a-hidroxilcsoportot pedig axiális helyzetbe irányítja.[1][2]
Hajos és Parrish a (+)-2 homológját, a 6,6-gyűrűs biciklusos ketolt (-)-5 is előállította. Ennek prolinnal katalizált szintézisében fontos az oldószer helyes megválasztása: a reakció N,N-dimetilformamidban (DMF) a 6,6-gyűrűs biciklusos ketolt, dimetil-szulfoxidban (DMSO) viszont az optikailag aktív Wieland–Miescher-ketont adja, ami a (+)-3 éndion 6,6-gyűrűs homológja.[3]
Az optikailag aktív Wieland–Miescher-ketont természetesen a 6,6-gyűrűs biciklusos ketol (-)-5 dehidratálásával is elő lehet állítani. Az eljárások részletes leírása ábrákkal az eredeti német szabadalomban és tudományos cikkben találhatók meg.[1][2]
Eder, Sauer és Wiechert nem biológiai körülmények között 47 mol% prolinnal 1M perklórsav jelenlétében acetonitrilben forralva közvetlenül a fent leírt éndiont (+)-3 állította elő. A Hajos, Parrish biciklusos ketolokat így természetesen nem tudták elkülöníteni.[4] Harminchét évvel később egy új csoport folytatta a Schering berlini kutatóintézetében Eder, Sauer és Wiechert munkáját. A Hajos-Parrish katalitikus eljárás megismétlésével az új csoportnak is sikerült az optikailag aktív 6,5-biciklusos ketolt előállítani.[5] A vegyület előállítását eddig csak a Hajos–Parrish közleményekben lehetett megtalálni.[1][2]
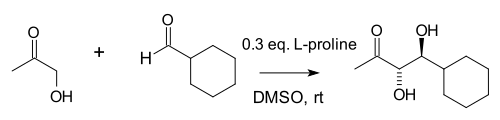
A kísérleti munka Hajos 1970 novemberében történt lemondása után hosszú ideig szünetelt ezen a szakterületen. 2000-ben Benjamin List és munkatársai azt találták, hogy intermolekuláris aldol addíciókat is lehetséges aldehidek és ketonok között létrehozni, csak lényegesen több prolint kell használni.[6]
A reakcióban nagy mennyiségű acetont (a keton reagens) kell használni, hogy a ketonnak prolinnal oxazolidinonhoz vezető reakcióját, valamint az aldehidnek prolinnal azometin-ilidhez vezető reakcióját visszaszorítsák. List és munkatársai kiterjesztették a reakciót 1,2-diolok előállítására is.[7]
Számos vegyületet vizsgáltak meg egy program keretében. Prolin és 5,5-dimetil-tiazolidinium-4-karboxilát tiazóliumsó voltak a leghatékonyabb katalizátorok az aminok nagy csoportjában.[8]
A Wieland–Miescher-keton aszimmetriás szintézise egy másik intramolekuláris prolinnal katalizált reakció, amit Barbas és munkatársai 2000-ben újra megvizsgáltak.[9]
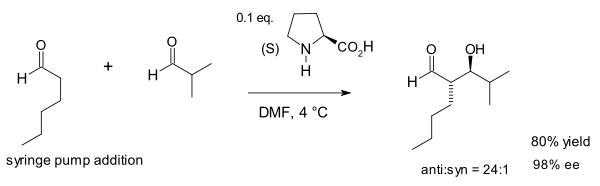
2002-ben David MacMillan és munkatársai kiterjesztették a prolinnal katalizált reakciót aldehideknek egymással történő aldol addíciójára.[10]
A reakció azért fontos, mert aldehidek rendszerint önmagukkal kondenzálnak.
Reakciómechanizmus
szerkesztésA triketon prolinnal katalizált aszimmetriás gyűrűzárására számos reakciómechanizmust javasoltak az évek során. Hajos (1974) egy enamin és egy hemiaminal (karbinolamin) mechanizmust is javasolt. Az enamin köztiterméket sztöchiometrikus mennyiségű 18O-dúsított vízzel végzett kísérletei alapján vetette el. E kísérletek ugyanis csak 7,2% 18O-dúsulást jeleztek. Egy ellenőrző kísérletben viszont maga a (+)-2 ketol reakciótermék 34,1% 18O-dúsulást mutatott. Az oxigénizotóp beépülését 18O-jelzett CO2 tömegspektrometriás mérésével határozták meg.[1][2]
A Hajos által 1974-ben javasolt hemiaminál (karbinolamin) egy iminium hidroxid tautomerré változhat. Az oldalláncban levő metil keton az iminium hidroxid hatására enolizál, majd gyűrű zárással az optikailag aktív biciklusos ketol reakció terméket (+)-2 adja a katalitikus mennyiségű (S)-(-)-prolin jelenlétében.
Hajos későbbi vizsgálódásai azt mutatták, hogy a Swaminathan és munkatársai által javasolt molekuláris sablon mechanizmus („template mechanism”) alacsonyabb energiaszinteket mutat, mint akár az enamin, akár a karbinolamin mechanizmus. A mechanizmus lényege, hogy a triketon prolinnal katalizált aszimmetriás gyűrűzárásában, az oldószerben gyakorlatilag oldhatatlan prolin molekuláris sablonként egy hidrogénkötéses komplexben fejti ki katalitikus és sztereo-dinamikus hatását.[11] Ez a mechanizmus nemcsak az intramolekuláris, hanem az intermolekuláris aldolreakciókat is megmagyarázhatja. Így nem kellene különleges elméletekkel magyarázni a víz jótékony hatását a köztudottan vízre érzékeny enamin köztitermékekre.
Az Agami-mechanizmus (1984) reakciókinetikai kísérletek alapján olyan enamin köztiterméket tételez fel, amelyben két prolin molekula vesz részt az átmeneti szerkezetben.[12] Houk mechanizmusa szerint (2001) egyetlen prolin molekula elegendő egy ciklusos átmeneti állapot létrehozására, amelyben a prolin karboxilcsoportja hidrogénkötésben van.[13][14]
List és munkatársai 2000-ben az intermolekuláris reakciókra is enamin köztiterméket tételeztek fel, és a megfigyelt sztereoszelektivitást a Zimmerman–Traxler-modell segítségével a Re oldalú (Re face) közelítéssel magyarázták. A prolin ketonnal képzett enaminja és az aldehid közti Re faciális közelítés azért kedvezőbb, mert a térigényes R csoport és az ugyancsak térigényes prolin egység a szék konformációjú, hattagú gyűrűs komplex ellentétes oldalán helyezkedik el. A komplexet a két oxigént és a prolin nitrogénjét összekötő hidrogénkötés tartja össze.
Az Si oldalú közelítésben a két térigényes csoport a szék konformációjú, hattagú gyűrűs komplex azonos oldalán helyezkedik el, térbeli taszítás áll elő, ezért a reagáló molekulák Si faciális közelítése előnytelen.[15] Mindezeket a következő ábra mutatja:
Houk és List szerint az eredeti Hajos-Parrish triketon reakciót is az enamin mechanizmus vezérli, de az Agami által javasolt két prolin molekulás köztiterméket[12] reakciókinetikai megfontolások alapján kétségbe vonták.[16] A reakció mechanizmust List H218O vízben végzett kísérlete támasztja alá, amely az oxigénizotópnak a reakciótermékbe való beépülését mutatja.[17] List ezért kizárta a Hajos féle aminal (karbinolamin) mechanizmust. List ugyanebben a cikkben leírta prolinnak acetonnal való reakcióját is, ami oxazolidinonhoz vezet:
Miután ennek a reakciónak az egyensúlyi állandója csak 0,12, ezért List arra a következtetésre jutott, hogy az oxazolidinon csak ún. „parasitic” (parazita-) szerepet játszik. Blackmond 2004-ben oxazolidinon köztitermékeket talált propanal és nitrozo-benzol prolinnal katalizált alfa-aminooxilációjában (NMR-es meghatározás):[18]
Chiong Teck Wong a szingapúri High Performance Computing Intézetben ugyanezt az oxiaminációs reakciót vizsgálta nitrozo-benzol és n-butanal modellen optikailag aktív prolinol-szilil-éter katalizátorral.[19] Wong kutatási eredményei megerősítik, hogy a katalizátor egy enolt hoz létre, és egy enol-katalizátor komplexet képez. A nitrozo-benzol azután az enol-katalizátor komplexszel reagálva főtermékként az (S)-N-nitrozo aldol terméket hozza létre a Pauling-féle elektronegativitási táblázatnak megfelelően. Az aldol keverék nátriumborohidrides redukciója a megfelelő alkoholokhoz vezet, ahol a PN/PO arány ≥ 99:1. A Wong által javasolt enol képző mechanizmus jól magyarázza a kísérletileg megfigyelt nagyfokú enantioszelektivitást. Wong eredményeit az alábbi ábra mutatja.
Seebach és Eschenmoser 2007-ben egy 47 oldalas (!) cikkben vitatták meg az oxazolidinoknak mint „parazita” köztitermékeknek a szerepét.[20] Cikkükben azt fejtegetik, hogy az oxazolidinok valójában kulcsponti szerepet játszanak a prolinnal katalizált reakciókban. Ennek alátámasztására ciklohexanonból és egy aktivált prolin származékból oxazolidinont állítottak elő, és azt klorállal reagáltatva aldol addíciós reakcióban a ciklohexanon és klorál aldolszármazékát nyerték 45%-os kitermeléssel. A diasztereo-szelektivitás (ds) 62%-os, az enantiomer arány (er) 76:24. A reakciót a következő ábra mutatja:
A reakció elnevezésének története
szerkesztés1985-ben Claude Agami professzor és munkatársai nevezték el először ezt a prolinnal katalizált Robinson típusú annulációt Hajos–Parrish-reakciónak.[21] 1986-ban Henri B. Kagan és Claude Agami professzorok[22] még mindig Hajos–Parrish-reakciónak nevezték a reakciót cikkük összefoglaló (Abstract) részében. 2001-ben Kagan professzor egy cikket közölt ”Nonlinear Effects in Asymmetric Catalysis: A Personal Account” címmel a Synlett c. folyóiratban.[23] E cikkben Kagan professzor már a „Hajos–Parrish–Wiechert-reakció” nevet használta. 2002-ben Benjamin List professzor még két nevet adott hozzá, és bevezette a „Hajos–Parrish–Eder–Sauer–Wiechert-reakció” elnevezést.[24] Az újabban szerves katalízisnek („Organocatalysis”) nevezett tudományos területen közölt cikkek még 2008-ban is 1985-ös, 2001-es, vagy 2002-es reakciónevet használnak.
Jegyzetek
szerkesztés- ↑ a b c d . Hajos, Z, G.; Parrish, D. R. Asymmetric Synthesis of Optically Active Polycyclic Organic Compunds. German Patent DE 2102623, July 29, 1971.
- ↑ a b c d Asymmetric synthesis of bicyclic intermediates of natural product chemistry Zoltan G. Hajos, David R. Parrish J. Org. Chem.; 1974; 39(12); 1615-1621. doi:10.1021/jo00925a003
- ↑ „Wieland–Miescher-keton” szócikk
- ↑ New Type of Asymmetric Cyclization to Optically Active Steroid CD Partial Structures Angewandte Chemie International Edition in English Volume 10, Issue 7, Date: July 1971, Pages: 496-497 Ulrich Eder, Gerhard Sauer, Rudolf Wiechert doi:10.1002/anie.197104961
- ↑ J.Org.Chem., 2008, 73, 5151-5154
- ↑ a b Proline-Catalyzed Direct Asymmetric Aldol Reactions Benjamin List*, Richard A. Lerner, and Carlos F. Barbas III J. Am. Chem. Soc. 2000; 122, 2395-2396 doi:10.1021/ja994280y
- ↑ Catalytic Asymmetric Synthesis of anti-1,2-Diols Wolfgang Notz and Benjamin List J. Am. Chem. Soc. 2000; 122(30) pp 7386 - 7387; (Communication) DOI: 10.1021/ja001460v
- ↑ Amino Acid Catalyzed Direct Asymmetric Aldol Reactions: A Bioorganic Approach to Catalytic Asymmetric Carbon-Carbon Bond-Forming Reactions Sakthivel, K.; Notz, W.; Bui, T.; Barbas, C. F., III J. Am. Chem. Soc. (Article); 2001; 123(22); 5260-5267. doi:10.1021/ja010037z
- ↑ A proline-catalyzed asymmetric Robinson annulation reaction Tetrahedron Letters, Volume 41, Issue 36, September 2000, Pages 6951-6954 Tommy Bui and Carlos F. Barbas doi:10.1016/S0040-4039(00)01180-1
- ↑ The First Direct and Enantioselective Cross-Aldol Reaction of Aldehydes Alan B. Northrup and David W. C. MacMillan J. Am. Chem. SOC. 2002; 124, 6798-6799 doi:10.1021/ja0262378
- ↑ Proline-catalysed asymmetric ketol cyclizations: The template mechanism revisited R.Malathi, D. Rajagopal, Zoltan G. Hajos and S. Swaminathan, J.Chem. Sci., Vol. 116, No.3, May 2004, 159-162
- ↑ a b a b Stereochemistry-59 : New insights into the mechanism of the proline-catalyzed asymmetric robinson cyclization; structure of two intermediates. asymmetric dehydration Tetrahedron, Volume 40, Issue 6, 1984, Pages 1031-1038 Claude Agami, Franck Meynier, Catherine Puchot, Jean Guilhem and Claudine Pascard doi:doi:10.1016/S0040-4020(01)91242-6
- ↑ The Origin of Stereoselectivity in Proline-Catalyzed Intramolecular Aldol Reactions Bahmanyar, S.; Houk, K. N. J. Am. Chem. Soc. (Communication); 2001; 123(51); 12911-12912. doi:10.1021/ja011714s
- ↑ Transition States of Amine-Catalyzed Aldol Reactions Involving Enamine Intermediates: Theoretical Studies of Mechanism, Reactivity, and Stereoselectivity Bahmanyar, S.; Houk, K. N. J. Am. Chem. Soc. 2001; 123(45); 11273-11283 doi:10.1021/ja011403h
- ↑ a b Proline-Catalyzed Direct Asymmetric Aldol Reactions Benjamin List*, Richard A. Lerner, and Carlos F. Barbas III J. Am. Chem. Soc. 2000, 122, 2395-2396 doi:10.1021/ja994280y
- ↑ Kinetic and Stereochemical Evidence for the Involvement of Only One Proline Molecule in the Transition States of Proline-Catalyzed Intra- and Intermolecular Aldol Reactions Linh Hoang, S. Bahmanyar, K. N. Houk, and Benjamin List J. Am. Chem. Soc. 2003, 125, 16-17 doi:10.1021/ja028634o
- ↑ Asymmetric Catalysis Special Feature Part II: New mechanistic studies on the proline-catalyzed aldol reaction Benjamin List, Linh Hoang, and Harry J. Martin PNAS 2004 101: 5839-5842; doi:10.1073/pnas.0307979101
- ↑ Probing the Active Catalyst in Product-Accelerated Proline-Mediated Reactions Iwamura, H.; Wells, D. H., Jr.; Mathew, S. P.; Klussmann, M.; Armstrong, A.; Blackmond, D. G. J. Am. Chem. Soc. (Communication); 2004; 126(50); 16312-16313. doi:10.1021/ja0444177
- ↑ A theoretical investigation on the mechanism of the alpha,alpha-diphenylprolinol trimethylsilyl ether-catalyzed oxyamination reaction, Chiong Teck Wong, Tetrahedron Letters 50 (2009) 811-813.
- ↑ Are Oxazolidinones Really Unproductive, Parasitic Species in Proline Catalysis? - Thoughts and Experiments Pointing to an Alternative View Helvetica Chimica Acta Volume 90, Issue 3, Date: March 2007, Pages: 425-471 Dieter Seebach, Albert K. Beck, D. Michael Badine, Michael Limbach, Albert Eschenmoser, Adi M. Treasurywala, Reinhard Hobi, Walter Prikoszovich, Bernard Linder doi:10.1002/hlca.200790050
- ↑ A New Diagnostic Tool for Elucidating the Mechanism of Enantioselective Reactions. Application to the Hajos-Parrish Reaction, Agami, C.; Levisalles, J.; Puchot, C. J. Chem. Soc., Chem. Commun. 1985, 8, 441-442
- ↑ Nonlinear Effects in Asymmetric Synthesis C. Puchot, O. Samuel, E. Dunach, S. Zhao, C. Agami, H. B. Kagan, J. Am. Chem. Soc. 1986, 108, 2353-2357
- ↑ Nonlinear Effects in Asymmetric Catalysis: A Personal Account H.B. Kagan et al., Synlett 2001, 888–899
- ↑ Proline-catalyzed asymmetric reactions B. List, Tetrahedron 58 (2002) 5573-5590