Dendrimer
| Ehhez a szócikkhez további forrásmegjelölések, lábjegyzetek szükségesek az ellenőrizhetőség érdekében. Emiatt nem tudjuk közvetlenül ellenőrizni, hogy a szócikkben szereplő állítások helytállóak-e. Segíts a szócikk fejlesztésében további megbízható források hozzáadásával. |
A dendrimerek elágazó szerkezetű molekulák, amelyek egy központi magból indulnak ki. A dendrimerek és a dendritikus polimerek kulcsfontosságú pozíciókat töltenek be az új technológiai alkalmazások között, az első dendrimer alapú gyógyszer várhatóan 2008-ban jelenik meg.[1] A dendrimerek kutatása lassan indult meg az 1970-es években, amikor Fritz Vögtle a Bonni Egyetemen és Donald A. Tomalia a Dow Chemicalnál megalkotta az első elágazó dendrimer molekulát.[2] A kutatás sebességére jellemző, hogy míg az 1990-es években csak tucatnyi publikáció jelent meg az irodalomban, 2004-ben már több mint 1000. Tudósok többféle dendrimeren kísérleteztek: grafitszerű-, kemilumineszcenciás tulajdonságokkal rendelkező-,[3] optikailag aktív,[4] fénygyűjtő-[5] (mesterséges fotoszintézis), heteroatomot tartalmazó (Si, P, B, Ge stb.),[6] keresztkötött dendrimerek stb.; a belső üregeket biomolekulák és gyógyszerek szállítására használták.
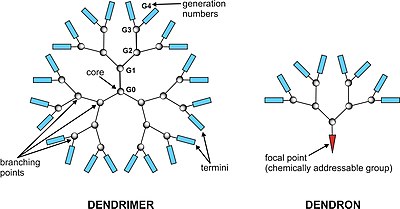
A makromolekulák egy egyszerű magból épülnek fel, erre rakódik egy-egy újabb generáció. A molekulák növekedésével azonban egyre kevesebb hely jut az új generációknak, a reakcióidő megnő illetve bonyolultabb összetételű vegyszerekkel kell majd reagáltassuk az a dendrimert. Ez magával hordozza a dendrimerek magas árát: 300 mg VII. generációs poliamid vagy PAMAM 600 $-ba, 2 g 10. generációs PAMAM dendrimer pedig 3800 euróba kerül.[7]
A dendrimerek típusai (történelmi áttekintés) szerkesztés
A szintetikus- és szerkezetfelderítésben elért fejlődésnek köszönhetően lehetővé vált a dendrimer kémia gyors fejlődése is, így nagyszámú dendritikus szerkezet jött létre, jól meghatározott nanoméretben (akár 3-5 nm a magasabb generációk esetében) és jól meghatározható számú funkciós csoportokkal. Az első ismétlődő szintézis Vögtle nevéhez fűződik, aki 1978-ban írt munkájában „kaszkád szintézisnek” nevezi el a módszert. Az 1980-as évek elején Denkewalter szabadalmaztatta az L-lizin alapú dendrimerek szintézisét. A szabadalom leírja a magasabb generációk szerkezetét, ám nem részletezi az anyagok tulajdonságait. Az első alaposabban elemzett dendritikus szerkezetek, melyek széles körű érdeklődésre tettek szert Tomalia PAMAM (poli(amido)amidoamin) dendrimerei és Newkome „arborol” (A görög „arbor”=fa szó nyomán, a „vízesésmolekula” szóösszetétel[8] is elfogadott) dendrimere. A PAMAM dendrimereket divergens módszerrel szintetizálják ammóniából vagy etilén-diaminból kiindulva. Felépítésüket a metil-akrilát kettős Michael addíciójával indítják a primer aminocsoportra, ezt követően a karbometoxi intermedier amidációja következik etildiaminban. Napjainkban már X. generációs dendrimereket is szintetizáltak 930 000 g/mólos molekulatömeggel (összehasonlításként megjegyezhetjük, hogy az egy szénatom atomtömege 12 g/mól, az emberi hemoglobin molekulatömege körülbelül 65 000 g/mól). A 10. generációs dendrimer előállításához 22 különböző reakcióra van szükség, melyek több hónapnyi szintetikus munkával járnak. 1993-ban Meijer a hollandiai DSM-ben Vögtle eredeti munkája nyomán divergens módszerrel (a magtól a perifériák felé haladva) szintetizálta a poli(propiléne imint). Napjainkra a PPI dendrimerek kereskedelmi forgalomban vannak. PPI (poli(propilén imin)) dendrimereket divergens módszerrel szintetizálják 1,4-diaminobutánból kiindulva. Ismétlődő reakcióban növesztik őket, mely az akrilnitril kettős Michael addíciójával indít a primer aminocsoportokra, majd egy hidrogénezéssel folytatódik Raney kobalt jelenlétében. Jelenleg az V.-ik generációig jutottak el. A DSM egyedi nevezéktannal nevezi el az általa előállított dendrimereket: a mag a diaminobután, dendr jelöli a belső dendritikus cellát, és az n a kapcsolódó csoportok száma. A PEI dendrimerek a PPI dendrimerek egyik alosztálya mely, poli(etilén imin) ágakra épül. A mag szerkezete diamino-etán és diamino-propán. A MAP-dendrimerek, melyek a sokszoros antigén peptid (Multiple Antigen Peptide) nevét jelöli, dendronszerű molekuláris szerkezet, mely polilizin vázra épül. A lizin az alkilamino oldaláncaival jó monomerként szolgál a találkozási pontok kialakításakor. Az első MAP dendrimert J. P. Tam szintetizálta 1988-ban, melynek felhasználása főképpen biológiai jellegű (oltások és diagnosztikai kutatások). A MAP eredetileg mag nélküli fa alakú dendron volt. Mégis, számtalan ezzel a módszerrel szintetizált dendrimer készült részmolekulák oldatban történő kapcsolódásával, dendrimerek felhasználásával vagy fordítva szilárd-fázis szintézissel. 1990-ben Fréchet bevezeti a konvergens szintézisi eljárást.[9][10] A konvergens módszer esetében a folyamat a perifériáktól indul a mag felé. Fréchet polimerjei könnyen szintetizálhatóak, így gyakran vizsgáljak a kutatók. Az 1990-es évek elején Jeffrey Moore fenilacetilén dendrimereket hozott létre konvergens úton. Az elmúlt öt év során újabb szintézis módszerek is felbukkantak, ezek azonban még kutatási fázisban vannak, és jelenleg nem rendelkeznek ipari alkalmazással.
A dendrimer kémia fontosabb kifejezései és nevezéktana szerkesztés
A dendrimer kémia más, specializálódott kutatási területhez hasonlóan önálló kifejezésekkel és rövidítésekkel rendelkezik. Továbbá egy sokkal rövidebb nomenklatúrát alkalmaznak a dendrimerek felszínén végbemenő változásokra. Ebben a fejezetben néhány fontosabb kifejezést és rövidítést fogok kifejteni. A dendron kifejezéssel jelöljük a dendritikus cikkelyt melynek nincs magja, a dendrimert két vagy több dendron egyesítésével alakíthatjuk ki. A dendronok nagyon hasznos eszközei a konvergens szintézisnek. A generáció jellemző minden dendrimeres és hiperelágazó szerkezetre. Generációval jelöljük az azonos rétegeket az elágazási pontok között. Az elágazási pontok száma a magtól a felszín fele haladva adja a generációk számát. A dendrimer szintézis intermedier szerkezeteit fél-generációknak nevezzük, jól ismert példa erre a karboxil savas végződésű PAMAM dendrimer mely néha az amino végződésű dendrimerek tulajdonságait veszi fel. A dendrimer héj egy összefüggő szerkezetű térbeli rész a gyújtópontok között. A „külső héj” a legkülső gyújtópont és a felszín közti tér. A „belső héjak” alatt a dendrimer belsejében található hasonló területek értendők. A felszíni csoportok alatt azokat a funkciós csoportokat értjük melyek a dendrimer külső részén találhatóak. A szó maga, felszíni csoport, elég pontatlan, mivel a dendrimer ágai néha a dendrimer belseje fele ágaznak el. Az aminó felszíni csoportokkal rendelkező dendrimereket „amin-végződésű dendrimereknek” hívjuk”. „Fekete gömb” (black ball) nomenklatúra: Mivel a nagy molekuláris szerkezet megnehezíti a szerkezet ábrázolását – például mikor a reakció a külső héjon vagy a felszínen megy végbe – a belső, változatlan részt egy fekete gömbbel jelölik. Ilyenformán a reakciók ábrázolása sokkal egyszerűbbé válik.[11]
A dendrimerek szintézise szerkesztés
A dendrimereket általában divergens vagy konvergens módszerrel állítjuk elő. A divergens módszer a magtól indítja a szintézist a perifériák felé. A központi molekula dendrimer-mag) reakcióba lép olyan monomer molekulákkal melyek egy reaktív és két védett csoportot tartalmaznak, így jön létre az első generációs dendrimer, majd az így kialakult periférián levő funkciós csoportok reakcióba lép újra a monomerekkel, a reakció lépést a kívánt generáció eléréséig ismétlik. A divergens módszer a dendrimerek nagy mennyiségű előállítására használható. Problémák léphetnek fel, azonban a csoportok mellékreakciói miatt melyek szerkezeti gondokhoz vezetnek majd. A mellékreakciók megelőzése érdekében nagy mennyiségű reagens túladagolás szükséges. Ez azonban bonyodalmat okoz a végső termék tisztításánál. A konvergens módszert a divergens módszer gyengeségeinek leküzdése érdekében fejlesztették ki. A konvergens módszer visszafele építi a molekulát, a külső csoportoktól halad a mag fele. Amikor az elágazó karok (dendronok) elég hosszúak egy multifunkciós maghoz kapcsolják. A konvergens módszernek számtalan előnye van:
- - Viszonylag könnyű tisztítani a végső terméket, mely minimális szerkezeti hibákkal állítható elő.
- - A kívánt csoportok precízebb elhelyezésével lehetővé válik a finom mérnöki munka molekulán
A konvergens megközelítés azonban nem teszi lehetővé a magasabb generációk előállítását, mert sztérikus problémák léphetnek fel a dendronok és a mag reakciója során.
Molekuláris szerkezet szerkesztés
Az alacsonyabb generációs dendrimereket (0, 1 és 2) az aszimmetrikus szerkezet jellemzi illetve sokkal több nyitott szerkezet mint a magasabb generációk esetében. A molekula növekedésével a dendrimerek globuláris szerkezetet vesznek fel. A dendronok összesűrűsödnek a perifériák fele való eltolódáskor. A kritikus elágazási állapot elérésekor a dendrimer növekedése helyszűke miatt megáll. Ez a „starburst (csillagszóró) effektus”. A PAMAM dendrimerek szintézisekor a hatás a 10. generáció után érződik. A reakció hatásfoka zuhanni kezd, a funkciós csoportok pedig nem kapcsolódnak a dendrimerhez. A 10. generációs PAMAM 6141 monomert tartalmaz, átmérője 124 A. A legmagasabb generációs dendrimerekre a funkciós csoportok magas száma és a belső üregek jelenléte jellemző.[12]
A dendrimerek fontosabb tulajdonságai szerkesztés
A lineáris molekulákkal ellentétben a dendrimerek monodiszperz makromolekulák. A klasszikus polimerizációs módszerek véletlenszerű termékeket eredményeznek, ezekkel ellentétben a dendrimerek specifikus szintézis módszerei lehetővé teszik a dendrimerek mérete és molekulatömege feletti ellenőrzést. A molekuláris szerkezetüknek hála sokkal jobb fizikai és kémiai tulajdonságokkal rendelkeznek, mint a lineáris polimerek. Oldatban az egyenes láncok felcsavarodnak, a dendrimereknél, éppen ellenkezőleg, szorosan csomagolt labda jön létre. A dendrimer oldatok viszkozitása jóval alacsonyabb lesz, mint a lineáris polimereké. A viszkozitás a negyedik generációnál éri el a maximumát, majd lassan csökkenni kezd, ez a viselkedés nem jellemző a lineáris polimerekre. A molekula szélén található funkciós csoportoknak köszönhető a nagyfokú oldódás- és reakciókészség. A dendrimer oldhatósága nagyban függ ezektől a csoportoktól. A hidrofil csoportokkal rendelkező dendrimerek oldhatóak poláros oldószerekben, a hidrofób csoportokat tartalmazók apoláris oldószerben oldódnak jól. Az alacsony generációs dendrimerek, melyek elég nagyok, hogy szferikusak legyenek, de nem hoznak létre sűrűn pakolt rendszert, hatalmas felülettel rendelkeznek a térfogatukhoz képest (akár 1000 m2/g). A dendrimerek néhány nagyon fontos egyedi tulajdonsággal is rendelkeznek a globuláris alaknak és a belső üregeknek köszönhetően. A legfontosabb, hogy más makromolekulákat zárhatunk ezekbe a cellákba. Meijer és munkatársai bengáli vörös és 4-nitrobenzol savat helyeztek egy poli(propilén-imin)-ben létrehozott „dendritikus doboz” belsejébe.[13]
Biológiai szempontból fontos tulajdonsága a dendrimereknek, hogy megfelelően megválasztott monomer esetén természetes makromolekulákhoz (pl. inzulin, hemoglobin) méretben és formában is nagymértékben hasonló molekulák állíthatók elő.
A dendrimerek felhasználása szerkesztés
Gyógyszerészeti felhasználás szerkesztés
Viva Gel szerkesztés
A dendrimerek szállítóközegként való felhasználása már rég felkeltette a tudósok figyelmét, a dendrimer maga azonban a Starpharma tudósainak köszönhetően vált gyógyszeralapanyaggá. A szóban forgó termék, a VivaGel, egy vaginális mikrobicid meggátolja a HIV-vel és más szexuális úton terjedő vírusokkal való fertőződést. A mikrobicid az első klinikai tesztekre küldött dendrimer alapú gyógyszer. Az embereken végrehajtott kísérletek után a Starpharma szeretné folytatni a kísérleteket, hogy 2008-ra piacra kerüljön a termék.
Az ENSZ AIDS (UNAIDS) programja szerint 40 millió HIV fertőzött él világszerte, 2006-ban pedig 4,3 millióval gyarapodott ez a szám. A megbetegedések számának csökkentése érdekében a figyelem a megelőzés fele összpontosult. A mikrobicidek ígéretes megelőző módszernek tűnnek a fejlődő országok esetében is.
A VivaGel HIV-ellenes mechanizmusa a dendrimerek polivalens tulajdonságát használja fel. Attól függően, hogy mely funkciós csoportokat csatolják a dendrimerhez más kapcsolatba lép a biológiai receptorokkal, így molekuláris tépőzárként (molecular Velcro) viselkednek. Egyszerre képesek többszörös reakcióra a biológiai receptorokon mint a vírusok és sejtmembránok.
A polivalens képesség egyfajta protein-protein és protein-membrán kötés utánzó képességet kölcsönöz a dendrimernek így jobb a hatásfoka mint egy „egyszer-kötő” molekulának. A VivaGel aktív alkotója a SPL7013 mely egy negyedik generációs polilizin dendrimer amelyben 32 diszulfonát csoport kapcsolódik amid kötésekkel a dendrimermaghoz. A polianionos szerkezet leköti a gp120-as glikoprotein receptorokat a vírus felszínén így gátolva meg a HIV fertőzést mert a vírus így nem tud kötődni a T-sejtekhez. A Starpharma 2005-ben sikeresen tesztelte a vírus állati megfelelőjén a szer működését. A vegyület aktivitást mutat más kórokozókkal szemben is, így a herpesz és a clamydia esetében is.
A sebhelyes szövet kialakulásának megelőzése szerkesztés
A Starpharma nincs egyedül a polivalens terápiák terén. Sunil Shaunak, az Imperial College London fertőzéses megbetegedések vizsgáló professzora és társai bejelentették, hogy meg tudják előzni sebhelyes szövet kialakítását aminoszaharidos és szulfatált amidoszacharidos végű dendrimerek esetében. Szerintük a terápia főképpen szemműtétek esetében lesz jelentős, ahol a legkisebb heg is vakságot okozhat. Shaunak próbálkozott a lineáris polimerek segítségével hasonló terápiákat kifejleszteni, de a polivalencia mellett sajnos a toxicitás erős fékezőerőként hatott. A dendrimerek toxicitása jelentősen kisebb mint az előzőekben vizsgált lineáris polimereké.
Stratus CS szerkesztés
Nemcsak a gyógyszergyártó cégek foglalkoznak dendrimerek felhasználásával, a molekulák diagnosztikus felhasználásban is bizonyítottak, így például A Dade Behring cég Stratus CS™ műszere is dendrimereket használ fel kardiológiai ellenőrzésre[14] A mérés során a véráramban keresnek olyan protein biomarkereket mellyel sérült szívizomra utalnak. A technológia immobilizált antitesteket használ fel a mintavevőn mely üvegszálas papírból készül. A dendrimerek „lehorgonyozzák” ezeket az antitesteket az üvegre. Azok az V. generációs dendrimerek melyeket a Stratus CS™ alkalmaz pozitívan töltöttek. Mindegyik antitest kovalensen csatlakozik a dendrimerhez mely immobilizálódik a negatív töltésű üvegen.[15] Az antitestek mindig jól helyezkednek el köszönhetően a dendrimerek által kialakított rendezett, megfelelő töltésű felszínnek. Mivel az antitestek nem vesznek kárba, egyetlen mikrogramnyi mennyiség is elég belőlük a vizsgálathoz.
MRI kontraszt közvetítők szerkesztés
A dendrimereket előzetes klinikai teszteknek vetették alá mágneses magrezonancia (MRI) esetén is, mint kontraszt közvetítők.[16][17] Az MRI anatómiai képeket képez a páciens szerveiről és véredényeiről. A beteget egy generált, jól meghatározott, inhomogén mágneses mezőbe helyezzük mely a víz nukleáris rezonanciáját eredményezi, melynek meghatározzák származási helyét és képpé alakítják. Kontraszt közvetítők hatására (paramágneses fém kationok) megnő az érzékenység és a pontosság. A dietilén-triamin-pentaecetsav (DTPA) gadolínium sóját használják fel erre a célra, de ez diffundál a extravénás területeken kis molekulatömegének köszönhetően. A dendrimerek tulajdonságaiknak köszönhetően megfelelők lennének erre a célra is. Néhány kutatócsoport már készített is gadolínium ionokat tartalmazó dendrimereket. Az előzetes tesztek azt mutatják, hogy a dendrimerek jobb kontraszt közvetítők mint az eddig használtak. Hasonló módon javítják a vérerek mágneses rezonanciás angiográfiájának (MRA) megjelenítését kiváló jel-zaj viszonyuknak köszönhetően. A legjobb dendrimer alapú MRI kontraszt közvetítők közül megemlíthető a Gadomer-17 amely egy polizin dendrimer Gd(III) komplexe, illetve a Dendritic Nanotechnologies olyan PAMAM dendrimerjei melyek kapszulaként tárolják a Magnevistet a dendrimer belsejében. A cég több éves kutatás után sikeresen állított elő anionos, alacsony toxicitású dendrimereket széles koncentrációs tartományban.
Hatóanyag célba juttatás szerkesztés
Vannak már próbálkozások a hatóanyag célba juttatás és más terápiás közvetítők terén is. A hatóanyagok raktározhatók a dendrimerek felületén és a belsejében is. Egyes szialódendrimerek megakadályozzák az emberi szervezetben levő eritociták agglutinációját amit influenza vírussal történő fertőzés idézhet elő. A sejtfertőzés első szakaszában a virion a sejtmembránhoz kapcsolódik. A kapcsolódás a vírus receptorainak hemoglutinjának és a sejt sziálsav csoportjainak kölcsönhatása nyomán következik be. A szialódendrimerek a hemoglutinhoz kapcsolódnak és megakadályozzák a vírus sejthez való kötődését. A dendrimerek hasznos terápiás szerek lehetnek a bakteriális és virális fertőzések megelőzésében. ?-szilánsav részek a dendrimerek felszínhez való kapcsolása által javítható a terápiás hatás. Vízben oldódó dendrimerek képesek rögzíteni és feloldani kisebb gomba- és baktériumölő tulajdonságokkal rendelkező savas hidrofób molekulákat. A rögzített szubsztrátum a célponthoz érve felszabadítható. A dendrimerek lehetnek burkolatképzők is melyek megvédik és elszállítják a anyagokat tetszőleges helyre a szervezetben vagy akár időzített szerkezetek melyek megfelelő időben engedik el a biológialag aktív szereket. Az 5-fluoracil (5FU) figyelemre méltó antitumor aktivitással rendelkezik, de toxikus mellékhatásai is vannak. Acetilezés után a PAMAM dendrimerek dendrimer-5FU konjugátumokat hoznak létre. A dendrimerek vízben oldódnak, hidrolizálnak, a konjugátumok pedig elengedik a szabad 5FU-t. A lassú elengedés csökkenti a toxikus hatást. A dendrimerek kitűnő szállítói lehetnek az antitumor gyógyszereknek.
Ipari felhasználás szerkesztés
Az ipari méretű szintézis útjába – az elektronikai iparban – azonban továbbra is beleszólnak a magas költségek, ám számos társaság kihasználva a dendrimerek felépítését hiperelágazó polimereket gyárt. Az Froehling által kifejlesztett polimer segített kifejlesztett Hybrane™ dendrimer, elágazó poli(észter amid) mely egy olyan monomeren alapúl melyet ciklikus anhidrid és diizopropanolaminból állítunk elő. A keletkező tercier amid két alkohol csoporttal rendelkezik valamint egy karboxilcsoporttal. A polimerizáció nagy tételben megvalósítható katalizátor nélkül. A DSM Hybrane™ különböző anhdrideket kombinálhat a végcsoportok kicserélésével így megváltoztatóak a hiperelágazó polimer tulajdonságai. A Hybrane™ fő felhasználási felülete a kőolajiparban van mivel segít az olaj-hidrátok (jégkristályok a kis szénatomszámú szénhidrogének körül) kialakulásának megelőzésében. Ezek a jégkristályok feltűnően stabilak relatív magas hőmérsékleteken és alacsony nyomáson. Az olaj-hidrátok eltömítik a kőolajvezetékeket és napi 1 millió dollárnyi kárt okoznak a kőolajiparnak. Az eltömődést úgy próbálják megelőzni, hogy szárítják majd termodinamikus inhibitorokat adnak a kőolajhoz így fagyásgátlót és metanolt. Több kutatás bizonyítja, hogy az elágazó molekulák mint a dendrimerek és az hiperelágazó molekulák képesek megadályozni a folyamatot. A DSM Hybrane™-ja az egyik ilyen, továbbá biodegradábilis és nem toxikus a tengeri élőlények számára. Az olajipar 2004 óta alkalmazza ezt a technológiát.[1] A svéd Perstorp cég a szintén hiperelágazó vegyületekkel foglalkozik, mint a Boltom™ amely 2,2-bisz-(hidroximetil)propionsav monomerre épül és az autóülésekben használják adalékanyagnak már másfélmillió autóban. A Boltom megnöveli a polimerek tartósságát, vízálló képességét illetve UV-fénnyel szemben ellenálló képességét. Annak ellenére, hogy egyre több cég vitte sikerre a dendrimereket a technológiáknak fejlődniük kell, hogy a dendrimerek eljussanak az őket megillető szintre. Az érdeklődés azonban már így is hatalmas, a nagyobb gyógyszergyártók rendre megjelennek a dendrimerrel foglalkozó konferenciákon. Több mint 50 dendrimer családot ismerünk, mindegyik egyedi tulajdonságokkal rendelkezik mivel felületük, belsejük és magjuk tetszés szerint alakítható a kívánt felhasználási módtól függően. Sok lehetséges alkalmazási mód kapcsolódik az egyedi molekuláris uniformitásukhoz, multifunkcionális felszínükhöz és a belső üregek jelenlétéhez. Ezek a tulajdonságok teszik lehetővé, hogy a legmodernebb technológiákban használják fel.
Hivatkozások szerkesztés
- ↑ Bethany Halford, Chemical & Engineering News – American Chemical Society, 2005, 83, 24 pp. 30-36
- ↑ C.R. Yates and W. Hayes, Mini-Reviews in Organic Chemistry, 2005, 2, 1-22
- ↑ Manabu Nakanozo, Li Ma, Kiyoshi Zaitsu, Tetrahedron Letters, 2002, 8185-8189
- ↑ Hak Fun Chow, Chi Ching Mak, J. Chem. Soc., Perkins Trans. , 1997, 1, 91-95
- ↑ Myung-Seok Choi, Tomoko Yamazaki, Iwao Yamazaki, Takuzo Aida, Angew. Chem. Int. Ed., 2004, 150-158
- ↑ Jean Pierre Majoral, Anne-Marie Caminade, Chem. Rev., 1999, 99, 845-880
- ↑ Sigma-Aldrich Catalog, 536776 Aldrich, CAS Number 163442-73-7, 2007
- ↑ HGeorge R. Newcome, Enfei He, Charles Moorefield, Chem. Rev., 99, 1689-1746
- ↑ Craig J. Hawker, J. M. J. Fréchet, J. Am. Chem. Soc., 1990, 112, 7638-7647
- ↑ Scott M. Grayson, Jeam M. J. Fréchet, Chem. Rev, 2001, 101, 3819-3867
- ↑ K. Boas, U. Cristensen, P.M.H. Heegaard, Dendrimers: Design, Synthesis and Chemical Properties, RSC 2005, Chapter 1, 2-7
- ↑ Munenori Numata, Atsushi Ikeda, Chie Fukuhara, Seiji Shinkai, Tetrahedron Letters, 1999, 40, 6945-6948
- ↑ H. Namazi, M. Adeli, Biomaterials, 2005, 26, 1175–1183
- ↑ Sara Altinier, Monica Mion, Anna Cappelletti, Martina Zaninotto, Mario Plebani, Clinical Chemistry, 2000, 46, No. 7, 991-993
- ↑ Joost Swaanenburg, Stan van den Broek, Harry de Wit, Evaluation of the Stratus Cardiac Status and the Triage Cardiac Panel point- of- care testing devices for performing troponion I, CKMB-mass and myoglobin measurements,
- ↑ Bernhard L. Gerber, David A. Bluemke, Bennett B. Chin, Raymond C. Boston, Alan W. Heldman, Joao A. C. Lima, Dara L. Kraitchman, Radiology, 2002, 225(1), 104-112
- ↑ Hisataka Kobayashi, Satomi Kawamoto, Robert A. Star, Thomas A. Waldmann, Yutaka Tagaya, Martin W. Brechbiel, Cancer research, 2003, 63, 271–276.
További információk szerkesztés
- Dendrimers (2,2-bis (methylol) Propionic Acid)
- Dr. F. Vögtle kutatócsoportjának honlapja
- Dendronok, dendrimerek, dendrigraftok (magyarul)
- A dendrimerek kitörőben (Chemical & Engineering News) (angolul)
- A Viva Gel gyártójának honlapja
- DSM Hybrane
- Egy 9. generacios PAMAM dendrimer adatlapja
- Dendrimeres szabadalmak