Klorát
| Klorát | |||
 Szerkezete és kötései | |||
 A klorátion | |||
| Más nevek | Klorát(V) | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 14866-68-3 | ||
| PubChem | 104770 | ||
| ChemSpider | 94578 | ||
| ChEBI | 49709 | ||
| |||
| InChIKey | XTEGARKTQYYJKE-UHFFFAOYSA-M | ||
| Gmelin | 1491 | ||
| UNII | 08Z8093742 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | ClO3- | ||
| Moláris tömeg | 83,4512 g/mol | ||
| Kristályszerkezet | |||
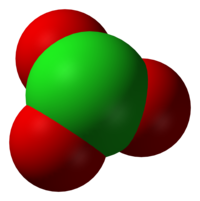
| Molekulaforma | Trigonális piramis | ||
| Veszélyek | |||
| Főbb veszélyek | oxidáns | ||
| Rokon vegyületek | |||
| Azonos kation | |||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A klorát a ClO−3 anion elterjedt neve, ahol a klór oxidációs száma 5. Az elnevezés utalhat a klorátiont tartalmazó vegyületekre is – a klorátok a klórsav sói és észterei. A klór többi oxoanionjának szabályos neve „klorát”, melyet zárójelben a klór oxidációs száma követ zárójelben, például a perklorát (ClO−4) esetén klorát(VII).
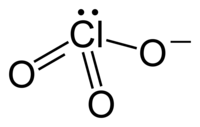
A vegyértékelektronpár-taszítási elméletnek megfelelően a klorátionok trigonális piramis alakúak.
A klorátok erős oxidálószerek, és szerves anyagoktól vagy könnyen oxidálható anyagoktól távol tartandók. A klorátok éghető anyaggal (például cukorral, fűrészporral, szénnel, szerves oldószerekkel, fémekkel) való keveréke könnyen deflagrálhat. Egykor pirotechnikai célra is használták ezért, de instabilitásuk miatt a stabilabb perklorátokat használják helyettük.
Szerkezet
szerkesztésA klorátion nem írható le megfelelően 1 Lewis-szerkezettel, mivel minden Cl–O kötés hossza azonos (kálium-klorátban 1,49 Å),[1] és a klór hipervalens. Ehelyett több rezonanciaszerkezet hibridje.
Előállítás
szerkesztésLaboratóriumi
szerkesztésA fém-klorátok klór forró fém-hidroxidokhoz, például kálium-hidroxidhoz adásával állítható elő:
E reakcióban a klór diszproporcionál, redukálódik és oxidálódik is. A 0 oxidációs számú klór Cl−-ra (oxidációs szám: –1) és ClO−3-ra (oxidációs szám: 5) bomlik. A hideg fém-hidroxid-oldatok reakciója klorid mellett hipokloritot ad.[2]
Ipari
szerkesztésAz ipari nátrium-klorát-előállítás vizes nátrium-klorid-oldatból indul ki, nem klórból. Ha az elektrolízis-felszerelés lehetővé teszi a klór és a nátrium-hidroxid keverését, a fent leírt diszproporcionáció történik. A reagensek 50–70 °C-ra hevülnek az elektrolízishez használt elektromos energia révén.[3]
Természetes előfordulás
szerkesztésEgy 2010-es tanulmány természetes klorátlerakódásokat mutatott ki világszerte, viszonylag magas koncentrációkkal a száraz és hiperszáraz területeken.[4] Esőmintákban is mérték a klorátszintet, ez a perklorátéhoz hasonlónak bizonyult. Feltehetően a klorát és perklorát természetes keletkezési mechanizmusa hasonló és a klór biogeokémiai ciklusának része lehet. Mikrobiális nézőpontból a természetes klorát magyarázhatja a klorátot kloridra redukáló mikroorganizmusok sokféleségét.
Klorátlégzés
szerkesztésA klorátredukció ősi jelenség lehet, mivel minden perklorátredukáló baktérium klorátot is használ terminális elektronakceptorként.[5] Nem ismert klorátdomináns ásvány, vagyis a klorát az ismert ásványokban csak helyettesítőként vagy a póruskitöltő oldatokban szerepel.[6] Klóroxoanion-bontó enzimek például a klorit-dizmutáz, a klorát- és a perklorát-reduktáz.
A klorátlégző egysejtűek feltehetően használhatók szennyeződések eltávolítására, észlelésére például kemosztátokban,[7]
A Földön kívül
szerkesztés2011-ben a Georgia Institute of Technology magnézium-klorátot mutatott ki a Marson.[8]
Sói
szerkesztésKlorátok például:
- kálium-klorát (KClO3)
- nátrium-klorát (NaClO3)
- magnézium-klorát (Mg(ClO3)2)
Egyéb oxoanionok
szerkesztésHa a klorátot zárójelbe tett római szám követi, az a megfelelő oxidációs számú klórt tartalmazó oxoaniont jelenti:
| Elterjedt név | Szabályos név | Oxidációs szám | Képlet |
|---|---|---|---|
| Hipoklorit | Klorát(I) | +1 | ClO− |
| Klorit | Klorát(III) | +3 | ClO−2 |
| Klorát | Klorát(V) | +5 | ClO−3 |
| Perklorát | Klorát(VII) | +7 | ClO−4 |
Ennek megfelelően a klorát bármely klóroxoaniont jelentheti. Általában a klorát az 5-ös oxidációs számú klórt tartalmazóra utal.
Toxicitás
szerkesztésA klorátok viszonylag mérgezők, azonban általában nem mérgező kloridokká redukálódnak.
Jegyzetek
szerkesztés- ↑ (1981) „The structure of potassium chlorate at 77 and 298 K”. Acta Crystallogr. B 37 (4), 913–915. o. DOI:10.1107/S0567740881004573.
- ↑ Chatenet M, Pollet BG, Dekel DR, Dionigi F, Deseure J, Millet P, Braatz RD, Bazant MZ, Eikerling M, Staffell I, Balcombe P, Shao-Horn Y, Schäfer H (2022. június 6.). „Water electrolysis: from textbook knowledge to the latest scientific strategies and industrial developments”. Chem Soc Rev 51 (11), 4583–4762. o. DOI:10.1039/d0cs01079k. PMID 35575644.
- ↑ Thompson, M. de Kay. Applied Electrochemistry. The MacMillan Company, 89-90. o. (1911)
- ↑ Rao, B. (2010). „Natural Chlorate in the Environment: Application of a New IC-ESI/MS/MS Method with a Cl18O−3 Internal Standard”. Environ. Sci. Technol. 44 (22), 8429–8434. o. DOI:10.1021/es1024228. PMID 20968289.
- ↑ Coates, J. D. (2004). „Microbial perchlorate reduction: rocket-fuelled metabolism”. Nature Reviews Microbiology 2 (July), 569–580. o. DOI:10.1038/nrmicro926. PMID 15197392.
- ↑ Home. mindat.org
- ↑ Ouwei Wang, John D. Coates (2017. november 24.). „Biotechnological Applications of Microbial (Per)chlorate Reduction”. Microorganisms 5 (4), 76. o. DOI:10.3390/microorganisms5040076. PMID 29816812. (Hozzáférés: 2023. szeptember 17.)
- ↑ „De l'EAU liquide répérée sur les pentes martiennes”, Le Temps , 2015. szeptember 28.. [2017. január 18-i dátummal az eredetiből archiválva] (Hozzáférés: 2024. április 24.)
További információk
szerkesztés- Chisholm, Hugh. Chlorates, Encyclopaedia Britannica Vol. 6, 11. (1911)