Propilén-oxid
| Propilén-oxid | |||
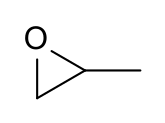 Szerkezeti képlet | |||
 A propilén-oxid pálcikamodellje | |||
| Más nevek | propilén-oxid epoxipropán propilén-epoxid 1,2-propilén-oxid metil-oxirán 1,2-epoxipropán Propén-oxid Metil-etilén-oxid | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 75-56-9 | ||
| PubChem | 6378 | ||
| ChemSpider | 6138 | ||
| EINECS-szám | 200-879-2 | ||
| KEGG | C15508 | ||
| ChEBI | 38685 | ||
| |||
| InChIKey | GOOHAUXETOMSMM-UHFFFAOYSA-N | ||
| UNII | Y4Y7NYD4BK | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C3H6O | ||
| Moláris tömeg | 58,08 g/mol | ||
| Megjelenés | színtelen folyadék | ||
| Szag | benzene-like[1] | ||
| Sűrűség | 0,859 g/cm3[2] | ||
| Olvadáspont | −111,9 °C | ||
| Forráspont | 35 °C | ||
| Oldhatóság (vízben) | 41% (20 °C)[1] | ||
| Mágneses szuszceptibilitás | −4,25·10−5=cm3/mol[3] | ||
| Törésmutató (nD) | 1,3660[2] | ||
| Gőznyomás | 445 Hgmm (20 °C)[1] | ||
| Termokémia | |||
| Std. képződési entalpia ΔfH |
−123,0 kJ·mol−1[4] | ||
| Standard moláris entrópia S |
196,5 J·(K·mol)−1 | ||
| Hőkapacitás, C | 120,4 J·(K·mol)−1 | ||
| Veszélyek | |||
| Főbb veszélyek | rendkívül gyúlékony[5][6] | ||
| NFPA 704 | |||
| Robbanási határ | 2,3–36%[1] | ||
| PEL | TWA 100 ppm (240 mg/m3)[1] | ||
| LD50 | 660 mg/kg (tengeri malac, szájon át) 380 mg/kg (patkány, szájon át) 440 mg/kg (egér, szájon át) 1140 mg/kg (patkány, szájon át) 690 mg/kg (tengeri malac, szájon át)[7] | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A propilén-oxid az epoxidok közé tartozó szerves vegyület, képlete CH3CHCH2O. Színtelen, illékony, éterre emlékeztető szagú folyadék. Az iparban nagy mennyiségben állítják elő, fő felhasználása a poliuretán műanyagok gyártásához használt poliéter-poliolok előállítása. Királis vegyület, de általában a racemátot használják.
Előállítása
szerkesztésA vegyiparban propilénből állítják elő.[8] Két általános utat követnek, az egyik a hidroklórozás, a másik az oxidálás.[9] 2005-ben a világ termelésének mintegy felét a klórhidrines technológiával, a másik felét az oxidációs eljárással állították elő, de utóbbi fontossága növekszik.[10]
Hidroklórozás
szerkesztésA hagyományos eljárás szerint a propént az alábbi egyszerűsített séma szerint propilén-klórhidrinné alakítják:
Az 1-klór-2-propanol és 2-klór-1-propanol keverékét ezután klórmentesítik, például:
A HCl elnyeletésére gyakran kalcium-hidroxidot alkalmaznak.
A propilén oxidációja
szerkesztésA másik eljárás a propilén szerves peroxiddal történő oxidációja. A reakció sztöchiometriája:
- CH3CH=CH2 + RO2H → CH3CHCH2O + ROH
A gyakorlatban négy hidroperoxidot használnak:[10]
- t-Butil-hidroperoxid, ezt az izobután oxigénezésével nyerik. A reakció végén t-butanol keletkezik, melyből dehidratálással izobutén nyerhető, melyet a benzinadalékként használt MTBE-vé lehet alakítani.
- Etilbenzol-hidroperoxid, ezt az etilbenzol oxigénezésével állítják elő. A reakcióban 1-feniletanollá alakul, melyből dehidratálással fontos monomer, sztirol nyerhető.
- Kumol-hidroperoxid, ezt a kumol (izopropilbenzol) oxigénezésével nyerik. A reakció során kumil-alkohol keletkezik belőle, melyet dehidratálással és hidrogénezéssel visszaalakítható kumollá. Ezt a technológiát a Sumitomo Chemical vezette be.[11]
- Hidrogén-peroxid, ezt a HPPO-eljárásban (hidrogén-peroxid–propilén-oxid) használják, a reakcióban katalizátorként titánnal adalékolt szilikalitot alkalmaznak:
- C3H6 + H2O2 → C3H6O + H2O
Elméletileg a folyamat során melléktermékként csak víz keletkezik, a gyakorlatban a propilén-oxid felnyílt gyűrűs származékai is megjelennek.[12]
Reakciói
szerkesztésMás oxidokhoz hasonlóan a propilén-oxid is a gyűrű felnyílásával járó reakciókban vesz részt. Vízzel propilén-glikol keletkezik. Alkoholokkal az etoxilezéssel analóg hidroxipropilezés játszódik le. Grignard-reagens addíciójával szekunder alkoholokat képez.
Néhány további reakciója:[13]
- Alumínium-oxiddal 250–260 °C-on reagálva propionaldehidet és kis mennyiségben acetont ad.
- Ezüst(I)-oxiddal reagálva ecetsavvá alakul.
- Nátriumamalgámmal és vízzel reagálva izopropanol keletkezik.
Felhasználása
szerkesztésAz előállított propilén-oxid 60-70%-át poliéter-poliollá alakítják az úgynevezett alkoxilezési folyamatban.[14] Ezek a poliolok a poliuretán műanyagok építőkövei.[15] A teljes mennyiség mintegy 20%-át propilén-glikollá hidrolizálják, ezt a folyamatot sav- vagy báziskatalízissel gyorstják. További fontos termékei a polipropilén-glikol, propilén-glikol-éterek és a propilén-karbonát.
Toxicitása
szerkesztésLehetséges emberi rákkeltő, az IARC 2B karcinogén listáján szereplő vegyület.[16]
Természetes előfordulása
szerkesztés2016-ban számoltak be arról, hogy a Tejútrendszerben található, hárommillió naptömegű Sagittarius B2 gázfelhőben propilén-oxidot találtak. Ez az első királis molekula, melynek jelenlétét kimutatták a világűrben.[17]
Jegyzetek
szerkesztés- ↑ a b c d e f g NIOSH Pocket Guide to Chemical Hazards #0538. National Institute for Occupational Safety and Health (NIOSH)
- ↑ a b c d Haynes 2011, p. 3.384
- ↑ Haynes 2011, p. 3.577
- ↑ Haynes 2011, p. 5.24
- ↑ "NFPA DIAMOND". www.otrain.com.
- ↑ GOV, NOAA Office of Response and Restoration, US. "PROPYLENE OXIDE | CAMEO Chemicals | NOAA". cameochemicals.noaa.gov.
- ↑ a b c Propylene oxide. Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH)
- ↑ (2006) „The Production of Propene Oxide: Catalytic Processes and Recent Developments”. Industrial & Engineering Chemistry Research 45 (10), 3447–3459. o. DOI:10.1021/ie0513090.
- ↑ Ullmann Vegyipari Enciklopédia
- ↑ a b (2006) „The Production of Propene Oxide: Catalytic Processes and Recent Developments”. Industrial & Engineering Chemistry Research 45 (10), 3447. o. DOI:10.1021/ie0513090.
- ↑ Summary of Sumitomo process from Nexant Reports. [2006. január 17-i dátummal az eredetiből archiválva]. (Hozzáférés: 2007. szeptember 18.)
- ↑ (2013) „Chemical and Technical Aspects of Propene Oxide Production via Hydrogen Peroxide (HPPO Process)”. Industrial & Engineering Chemistry Research 52 (3), 1168–1178. o. DOI:10.1021/ie3023862.
- ↑ Dictionary of Organic Compounds. Oxford University Press, 249. o. (1953. november 4.)
- ↑ Ullmann Vegyipari Enciklopédia
- ↑ Usage of proplyene oxide. Dow Chemical. [2007. szeptember 15-i dátummal az eredetiből archiválva]. (Hozzáférés: 2007. szeptember 10.)
- ↑ (2014. május 13.) „E-cigarettes: a scientific review”. Circulation 129 (19), 1972–1986. o. DOI:10.1161/circulationaha.114.007667. PMID 24821826. PMC 4018182.
- ↑ Scientists just detected this life-forming molecule in interstellar space for the first time. Science Alert, 2016. június 15.
Fordítás
szerkesztés- Ez a szócikk részben vagy egészben a Propylene oxide című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források
szerkesztés- CRC Handbook of Chemistry and Physics, 92nd, Boca Raton, FL: CRC Press (2011. november 4.). ISBN 1439855110
További információk
szerkesztés- WebBook page for C3H6O
- Propylene oxide at the United States Environmental Protection Agency
- Propylene oxide – chemical product info: properties, production, applications.
- Propylene oxide at the Technology Transfer Network Air Toxics Web Site
- CDC – NIOSH Pocket Guide to Chemical Hazards
