Etilén-diamin
| Etilén-diamin | |||
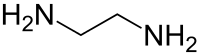 Az etilén-diamin szerkezeti képlete | |||
 Az etilén-diamin pálcikamodellje |
 Az etilén-diamin kalottamodellje | ||
| Szabályos név | etán-1,2-diamin[1] | ||
| Más nevek | edamin[2] 1,2-diaminoetán, ligandumként „en” | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| Rövidítés | en | ||
| CAS-szám | 107-15-3 | ||
| PubChem | 3301 | ||
| ChemSpider | 13835550 | ||
| EINECS-szám | 203-468-6 | ||
| KEGG | D01114 | ||
| MeSH | ethylenediamine | ||
| ChEBI | 30347 | ||
| RTECS szám | KH8575000 | ||
| |||
| InChIKey | PIICEJLVQHRZGT-UHFFFAOYSA-N | ||
| Beilstein | 605263 | ||
| Gmelin | 1098 | ||
| UNII | 60V9STC53F | ||
| ChEMBL | 816 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C2H8N2 | ||
| Moláris tömeg | 60,10 g/mol | ||
| Megjelenés | színtelen folyadék[3] | ||
| Szag | ammóniára emlékeztető[3] | ||
| Sűrűség | 0,90 g/cm3[3] | ||
| Olvadáspont | 8 °C | ||
| Forráspont | 116 °C | ||
| Oldhatóság (vízben) | korlátlanul elegyedik | ||
| Mágneses szuszceptibilitás | −46,26·10−6 cm3/mol −76,2·10−6 cm3/mol (HCl só) | ||
| Törésmutató (nD) | 1,4565 | ||
| Gőznyomás | 1,3 kPa (20 °C-on) | ||
| kH | 5,8 mol Pa−1 kg−1 | ||
| Megoszlási hányados | −2,057 | ||
| Termokémia | |||
| Std. képződési entalpia ΔfH |
−63,55–−62,47 kJ mol−1 | ||
| Égés standard- entalpiája ΔcH |
−1,8678–−1,8668 MJ mol−1 | ||
| Standard moláris entrópia S |
202,42 J K−1 mol−1 | ||
| Hőkapacitás, C | 172,59 J K−1 mol−1 | ||
| Veszélyek | |||
| NFPA 704 | |||
| Robbanási határ | 2,7–16% | ||
| PEL | TWA 10 ppm (25 mg/m3)[5] | ||
| LD50 | 500 mg/kg (patkány, szájon át) 470 mg/kg (tengeri malac, szájon át) 1160 mg/kg (patkány, szájon át)[4] | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
Az etilén-diamin (ligandumként rövidítése en) szerves vegyület, képlete C2H4(NH2)2. Színtelen, ammóniára emlékeztető szagú folyadék, erősen bázisos amin. Kémiai szintézisekben széles körben alkalmazzák, 1998-ban mintegy 500 000 tonnát állítottak elő belőle.[6] Készségesen reagál a párás levegő víztartalmával, ekkor korrozív, mérgező és irritáló köd képződik, mely már rövid ideig tartó kitettség esetén is súlyos egészségkárosodást okozhat. Az úgynevezett polietilén-aminok sorozatának első tagja.
Előállítása szerkesztés
Iparilag 1,2-diklóretán ammóniával történő kezelésével állítják elő nyomás alatt, 180 °C hőmérsékleten vizes közegben:[6][7]
A reakció során hidrogén-klorid keletkezik, mely az aminnal sót képez. Az amint nátrium-hidroxid hozzáadásával szabadítják fel, majd rektifikációval nyerik ki. Melléktermékként dietilén-triamin (DETA) és trietilén-tetramin (TETA) keletkezik.
Egy másik ipari eljárás szerint etanolamint reagáltatnak ammóniával:[8]
Ebben a folyamatban a gázállapotú reaktánsokat nikkel heterogén katalizátor felett vezetik át.
Vízmentesítése nátrium-hidroxidos kezeléssel, majd azt követő desztillációval történhet.[9]
Felhasználása szerkesztés
A vegyipar nagy mennyiségben használja különféle vegyületek előállítására. Származékokat képez karbonsavakkal (köztük a zsírsavakkal), nitrilekkel, alkoholokkal (magasabb hőmérsékleten), alkilezőszerekkel, szén-diszulfiddal, valamint aldehidekkel és ketonokkal. Bifunkciós – két aminocsoportot tartalmazó – szerkezete miatt könnyen képez heterociklusokat, például imidazolidineket.
Kelátképzők, gyógyszerek és agrokemikáliák előállítása szerkesztés
Legismertebb származéka az EDTA kelétképző, melyet etilén-diaminból kiinduló Strecker-szintézissel állítanak elő cianid és formaldehid felhasználásával. Másik kereskedelmileg fontos kelétképző a hidroxietil-etilén-diamin.[6] Számos bioaktív vegyületben és gyógyszermolekulában található N-CH2-CH2-N kötés, köztük egyes antihisztaminokban is.[10]
A gyógyszeriparban szerkesztés
Az aminofillin nevű hörgőtágító gyógyszerben a teofillin hatóanyagot szolubilizáló segédanyagként alkalmazzák. Ezen kívül bőrgyógyászati készítményekben is alkalmazták, de ezek egy részéből már kivonták, mivel kontakt dermatitiszt okozott.[11] Gyógyszerkészítmény segédanyagaként szájon át történő alkalmazás esetén a biológiai hasznosulása – a jelentős first-pass effektus miatt – kb. 34%, a vizelettel kevesebb, mint 20% ürül.[12]
Az etilén-diamin alapú antihisztaminok az első generációs antihisztaminok öt családja közül a legrégebbiek, kezdve az 1933-ban a franciaországi Pasteur Intézetben felfedezett piperoxánnal (más néven benodain), de ide tartozik a mepiramin, tripelennamin és az antazolin is. A többi osztály etanolamin, alkil-amin, piperazin és más vegyületek (szerkezetileg a fenotiazin, triciklusos antidepresszánsok, valamint a ciproheptadin-fenindamin család vegyületeihez hasonlító, főként tri- és tetraciklusok) származékai.
Műanyagokban szerkesztés
Két amincsoportjának köszönhetően széles körben használják különféle polimerek előállításához. Formaldehiddel képzett kondenzációs származékai lágyítószerek. Széles körben használják poliuretán szálak gyártásához is.
További felhasználásai szerkesztés
- Oldószerként: poláris oldószerekkel elegyedik, fehérjék, például albuminok és kazein szolubilizálására használják.
- Korróziógátlóként festékekben és hűtőfolyadékokban.
- Állatok takarmányába jodidforrásként etilén-diamin-dihidrojodidot adnak
Koordinációs kémia szerkesztés
A koordinációs kémiában jól ismert kétfogú (bidentát) kelátképző ligandum, melyben a két nitrogénatom nemkötő elektronpárja koordinálódik a központi ionhoz. Ligandumként rövidítése „en”. A [Co(etilén-diamin)3]3+ komplex a királis trisz-kelát komplexek alaptípusa. A szalén ligandumokat – melyek némelyikét katalizátorként használják – szalicilaldehidek és etilén-diamin kondenzációjával nyerik.
Hasonló ligandumok szerkesztés
Hasonló származékai a tetrametiletilén-diamin (TMEDA) és a tetraetiletilén-diamin (TEEDA). Királis analógjai többek között az 1,2-diaminopropán és a transz-diaminociklohexán.
Biztonságtechnikai információk szerkesztés
Az ammóniához és más kis molekulatömegű aminokhoz hasonlóan irritálja a bőrt és a légzőrendszert. Ha nem jól záródó edényben tárolják, a folyékony anyag párolgása mérgező és irritáló gőzt bocsát ki a környezetbe, különösen melegítés hatására. A gőzök a levegő páratartalmával reagálva jellegzetes fehér ködöt képeznek, mely rendkívül erősen irritálja a bőrt, a szemet, a tüdőket és a nyálkahártyákat.
Hivatkozások szerkesztés
- ↑ ethylenediamine - Compound Summary. PubChem Compound. National Center for Biotechnology Information, 2004. szeptember 16. (Hozzáférés: 2012. május 3.)
- ↑ A Tanács 129/2007/EK rendelete (2007. február 12.) a Világegészségügyi Szervezet által adott, nem védett nemzetközi nevet (INN) viselő egyes gyógyszerhatóanyagok, továbbá gyógyszeripari végtermékek gyártásához használt egyes termékek vámmentességének megadásáról. Európai Unió Kiadóhivatala, 2007. február 12. (Hozzáférés: 2020. április 1.)
- ↑ a b c d e f g A [1] tartozó bejegyzés az IFA GESTIS adatbázisából. (JavaScript szükséges) (angolul)
- ↑ Ethylenediamine. Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH)
- ↑ a b c NIOSH Pocket Guide to Chemical Hazards #0269. National Institute for Occupational Safety and Health (NIOSH)
- ↑ a b c Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke "Amines, Aliphatic" in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH Verlag, Weinheim. doi:10.1002/14356007.a02_001
- ↑ Hans-Jürgen Arpe, Industrielle Organische Chemie, 6. Auflage (2007), Seite 245, Wiley VCH
- ↑ Hans-Jürgen Arpe, Industrielle Organische Chemie, 6. Auflage (2007), Seite 275, Wiley VCH
- ↑ Tris(ethylenediamine)chromium(III) Salts, Inorganic Syntheses, Inorganic Syntheses, 196–200. o.. DOI: 10.1002/9780470132333.ch60 (1946). ISBN 9780470132333
- ↑ Kotti, S. R. S. S. (2006). „Vicinal diamino functionalities as privileged structural elements in biologically active compounds and exploitation of their synthetic chemistry”. Chemical Biology & Drug Design 67 (2), 101–114. o. DOI:10.1111/j.1747-0285.2006.00347.x. PMID 16492158.
- ↑ Hogan DJ (1990. január 1.). „Allergic contact dermatitis to ethylenediamine. A continuing problem.”. Dermatol Clin. 8 (1), 133–6. o. DOI:10.1016/S0733-8635(18)30536-9. PMID 2137392.
- ↑ Zuidema J. (1985. augusztus 23.). „Ethylenediamine, profile of a sensitizing excipient.”. Pharmacy World & Science 7 (4), 134–40. o. DOI:10.1007/BF02097249. PMID 3900925.
Fordítás szerkesztés
Ez a szócikk részben vagy egészben az Ethylenediamine című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
