Ecetsav
| Ecetsav | |||
 |

| ||
 |

| ||
| IUPAC-név | ecetsav | ||
| Szabályos név | etánsav | ||
| Más nevek | metánkarbonsav acetil-hidroxid (AcOH) hidrogén-acetát (HAc) | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 64-19-7 | ||
| ATC kód | G01AD02, S02AA10 | ||
| Gyógyszer szabadnév | acetic acid | ||
| Gyógyszerkönyvi név | Acidum aceticum glaciale | ||
| |||
| Kémiai és fizikai tulajdonságok | |||
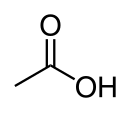
| Kémiai képlet | CH3COOH | ||
| Moláris tömeg | 60,05 g/mol | ||
| Megjelenés | színtelen folyadék vagy kristály | ||
| Sűrűség | 1,049 g/cm³, folyadék 1,266 g/cm³, szilárd | ||
| Olvadáspont | 16,5 °C | ||
| Forráspont | 118,1 °C | ||
| Oldhatóság (vízben) | korlátlanul elegyedik | ||
| Savasság (pKa) | 4,73 (25 °C) | ||
| Viszkozitás | 1,22 mPa·s (25 °C) | ||
| Kristályszerkezet | |||
| Dipólusmomentum | 1,74 D (gáz) | ||
| Veszélyek | |||
| EU osztályozás | Maró (C)[1] | ||
| R mondatok | R10, R35[1] | ||
| S mondatok | (S1/2), S23, S26 S45[1] | ||
| LD50 | 3310 mg/kg (patkány, szájon át)[2] | ||
| Rokon vegyületek | |||
| Rokon karbonsavak | hangyasav propionsav | ||
| Rokon vegyületek | acetamid, etil-acetát, acetil-klorid, ecetsav-anhidrid, acetonitril, acetaldehid, etanol, tioecetsav | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
Az ecetsav, más néven etánsav szerves vegyület, képlete CH3COOH. Könnyen felismerhető, mert ez adja az ecet savanyú ízét és átható szagát.
A tiszta, vízmentes ecetsav (a jégecet) színtelen folyadék, amely vizet köt meg a környezetéből (higroszkópos), 16,7 °C alatt megfagy, és színtelen kristályt képez. Az ecetsav maró hatású, gőzei ingerlik a szemet, az orr- és a toroknyálkahártyát, a tüdőt, annak ellenére, hogy vizes oldatban kevésbé disszociál, mivel gyenge sav.
Az ecetsav az egyik legegyszerűbb karbonsav (a második legegyszerűbb a hangyasav után).
Fontos kémiai reagens és ipari nyersanyag. Főként a polietilén-tereftalát (szénsavas italok palackjai), cellulóz-acetát (fényképészeti film), polivinil-acetát (ragasztó), valamint mesterséges szálasanyagok (acetátszál) gyártásában, a textiliparban mint kikészítési segédanyagot (pl. pH-beállításra) használják.
A háztartásban az ételecet sűrűbb változata takarítási célra vízkőoldó és kíméletesebb fertőtlenítőszer gyanánt, a hígabb pedig az ételek ízesítő anyagaként, illetve gyógyhatású készítményként fogyasztva használatos.
Az élelmiszeriparban az ecetsavat E260-nal jelölik, és a savanyúság szabályozására használják. A világ ecetsavigénye mintegy 6,5 millió tonna évente (6,5 Mt/a); ebből kb. 1,5 Mt/a újrahasznosításból származik, a többit a kőolajipar állítja elő, illetve biológiai forrásokból nyerik.
Nevezéktan
szerkesztésA triviális ecetsav elnevezést igen széles körben használják, és a IUPAC is támogatja. A név az ecet latin megfelelőjéből, az acetum szóból származik. Az etánsav a vegyület szisztematikus neve, mellyel főleg a kémiai nevezéktan alapjait ismertető leírásokban találkozhatunk.
A jégecet név a vízmentes ecetsav hétköznapi elnevezése. A német névhez (Eisessig) (szó szerinti fordításban, jég-ecet) hasonlóan, az elnevezés a kevéssel szobahőmérséklet alatt, 16,7 °C-on kialakuló jégszerű kristályokra utal.
A leggyakoribb, hivatalosan is elfogadott rövidítés az AcOH vagy HOAc jelölés, ahol az Ac a CH3−C(=O)− acetilcsoportot jelöli. Sav-bázis reakciók leírásakor gyakran előfordul a HAc jelölés, ahol a korábbiaktól eltérően az Ac az acetát anion (CH3COO−) jelölése. Ezt a jelölésmódot azonban sokan félrevezetőnek tartják. Az Ac jelet semmi esetre sem szabad összekeverni az aktínium nevű elem vegyjelével.
Az ecetsav tapasztalati képlete CH2O, összegképlete C2H4O2. Utóbbit gyakran írják a szerkezetet jobban tükröző CH3−COOH, CH3COOH, vagy CH3CO2H formában. Az ecetsavból H+ ion elvesztésével keletkező ion az acetát anion. Az acetát név utalhat még acetátiont tartalmazó sókra vagy az ecetsav észtereire.
Történet
szerkesztésAz ecet egyidős az emberi civilizációval, talán még idősebb is annál. Ecetsavtermelő baktériumok a világon mindenütt előfordulnak és minden kultúra, ahol ismerték a sör vagy a bor készítését, elkerülhetetlenül felfedezte az ecetet mint annak következményét, ha ezeket az alkoholos italokat hosszasan levegővel érintkezni hagyták.
Az ecetsav kémiai felhasználása igen messzire nyúlik vissza. Az ie. 3. században Theophrasztosz görög filozófus leírta, hogy ecet és különböző fémek kölcsönhatásával hogy lehet a művészek számára értékes színezőanyagokat előállítani. Ilyen volt az ólomfehér (ólom-karbonát) és a verdigris, egy rézsókat, többek között réz(II)-acetátot tartalmazó zöld festék. Az ókori rómaiak a megecetesedett bort ólomedényekben forralták, hogy az igen édes, sapának nevezett sziruphoz jussanak. A sapa sok ólom-acetátot tartalmazott, amit édes íze miatt ólomcukornak, illetve Szaturnusz-cukornak is neveznek. Ez feltehetően hozzájárult a római arisztokrácia körében előforduló ólommérgezésekhez.
A 8. században Dzsábir ibn Hajján perzsa alkimista ecet desztillálásával tömény ecetsavat állított elő. A reneszánsz idején az ecetsavat fém-acetátokból állították elő száraz desztillációval. A 16. században Andreas Libavius német alkimista írt le egy ilyen eljárást és az így nyert jégecetet összehasonlította a közönséges ételecettel. Az ételecetben lévő víz azonban olyan mértékben változtatja meg az ecetsav tulajdonságait, hogy sok vegyész évszázadokon át úgy hitte, az ételecetben talált sav és a jégecetet alkotó sav két különböző vegyület. Pierre Adet francia vegyész bizonyította be, hogy a két anyag azonos. 1847-ben Hermann Kolbe német kémikus első ízben állított elő ecetsavat szervetlen vegyületekből. Az eljárás során szén-diszulfidból klórozással szén-tetrakloridot állított elő, melyből pirolízissel tetraklóretilént nyert. Ezt a vegyületet vizes klórozással triklórecetsavvá alakította, amiből elektrolitikus redukcióval jutott az ecetsavhoz. 1910-re a jégecet legfontosabb forrása a fa száraz lepárlásakor keletkező „faszesz” lett. Az ecetsav elkülönítésére mésztejet adtak hozzá, majd a keletkező kalcium-acetátból kénsavval szabadították fel. Ebben az időben Németország évi 10 000 tonna jégecetet állított elő, melynek közel 30%-át az indigó nevű színezék előállítására használták.
Az ecet mint élelmiszer
szerkesztésAz ecet olyan termék, amelyet mezőgazdasági eredetű nyersanyagok kettős fermentációjával (alkoholos-ecetsavas) állítanak elő. A tömény ecetsav (ecetjég) közvetlen fogyasztásra nem kerülhet. Az élelmiszeripari felhasználásra - a maró hatása miatt engedélyköteles - 50-80 százalékos vizes oldatot forgalmaznak, a kiskereskedelemben általában 5-20 százalékos oldata vásárolható meg. Az ecetsavat élelmiszer adalékanyagként E 260-nal jelölik. A biológiai úton előállított ecetek sajátossága, hogy megőrzik az alapanyaguk íz- és illatanyagát, valamint beltartalmi értékeikből értékes összetevőket.[3] A kézműves ecet csak hagyományos módon készülhet, legalább 3 hónapos erjesztést követően lehet forgalomba bocsátani. [4]
Kémiai tulajdonságok
szerkesztésSavasság
szerkesztésAz ecetsav és a többi karbonsav karboxilcsoportjában (−COOH) található hidrogén (H) H+ ion (proton) formájában lehasadhat, ami savas jelleget ad a vegyületeknek. Az ecetsav vízzel szemben gyenge, egyértékű savként viselkedik, pKa = 4,8 értékkel. Konjugált bázispárja az acetátion (CH3COO−). 1,0 mol/dm³ koncentrációjú oldatának (ez közelítőleg a háztartási ecet töménységének felel meg: 6%-os) pH-ja 2,4, ami azt jelenti, hogy az ecetsavmolekuláknak mindössze 0,4%-a található disszociált állapotban.
Ciklikus dimer
szerkesztésAz ecetsav kristályszerkezetének vizsgálata azt mutatta, hogy a molekulák dimerekké állnak össze, melyeket hidrogénkötések tartanak össze. Ezek a dimerek az ecetsav gőzeiben is kimutathatóak 120 °C-on. Folyadékfázisban is előfordulnak, hidrogénkötések kialakítására nem képes oldószerrel készült híg ecetsavoldatokban, és bizonyos mértékben magában a tiszta ecetsavban is. Hidrogénkötések kialakítására képes oldószerekben azonban szétesik a dimer. A dimer disszociációs entalpiája a becslések szerint 65,0–66,0 kJ/mol, disszociációs entrópiája 154–157 J·mol−1·K−1. Ez a dimerizációs hajlam más kisméretű karbonsavakra is jellemző.
Az ecetsav mint oldószer
szerkesztésA folyékony ecetsav hidrofil (poláris), protikus oldószer, az etanolhoz és a vízhez hasonlóan. Közepes dielektromos állandójával nem csak a poláris anyagok, mint a szervetlen sók és cukrok, de az apoláris vegyületek, például olajok illetve egyes elemek: a kén és jód oldószere is lehet. Készségesen elegyedik számos poláris és nem poláris oldószerrel, mint például a vízzel, kloroformmal, hexánnal. Oldóképessége és elegyedési hajlama miatt fontos ipari vegyszer.
Kémiai reakciók
szerkesztésAz ecetsav számos fémet megtámad, többek között a vasat, magnéziumot és cinket, melyekkel hidrogén fejlődése mellett fém-acetát sókat képez. Az alumínium felületén, oxigénnel érintkezve vékony alumínium-oxid réteg képződik, amely ellenáll az ecetsavnak, így az ecetsav alumíniumból készült tartályokban szállítható. A fém-acetátok ecetsavból is előállíthatóak megfelelő bázis segítségével, mint ahogyan az a „sütőpor + ételecet” kölcsönhatásból közismert. Szinte minden acetát jól oldódik vízben. Érdekes kivételt jelent a króm(II)-acetát.
- NaHCO3(s) + CH3COOH(aq) → CH3COONa(aq) + CO2(g) + H2O(f)
Az ecetsav adja a karbonsavak jellemző kémiai reakciói, például lúgokkal a megfelelő acetátsót képezi. Karbonátokkal és hidrogénkarbonátokkal szén-dioxid és víz keletkezése mellett úgyszintén fém-acetátokat alkot. Reakciói közül az egyik legfontosabb az ecetsav etanollá történő redukciója. Fontos sajátsága az ecetsavnak, hogy nukleofil szubsztitúcióval olyan származékok nyerhetők belőle, mint az acetil-klorid. A két savmolekulából vízkilépéssel keletkező ecetsav-anhidrid is fontos vegyület. Az ecetsavból észterek állíthatóak elő Fischer észteresítéssel, illetve amidok is nyerhetőek belőle. 440 °C fölé hevítve az ecetsav szén-dioxidra és metánra, illetve keténre és vízre bomlik.
Kimutatása
szerkesztésAz ecetsav felismerhető szúrós szagáról. Az acetátok jellemző színreakciót adnak vas(III)-klorid oldattal, az oldat mélyvörös színű lesz, de savanyítás hatására elszíntelenedik. Arzén-trioxiddal hevítve az acetátok kellemetlen, jellegzetes szagú kakodil-oxid (bisz[dimetil-arzén(III)]-oxid) keletkezése közben reagálnak.
Gyártása
szerkesztésGyártható mesterségesen más anyagokból, de készülhet erjesztéssel is. Habár az erjesztéssel készült ecet csak a világtermelés kb. 10%-a, bizonyos országokban a törvények kikötik, hogy étkezési célra csak természetes eredetű ecetet használhatnak. Nagyjából 75%-a metanolból és szén-monoxidból készül.
Metanol karbonilezése
szerkesztésA gyártás során metanolból és szén-monoxidból ecetsav keletkezik a következő egyenlet szerint:
- CH3OH + CO → CH3COOH
A háromlépéses folyamatban jódmetán is keletkezik. Az acetil-jodidot előállító karbonilezési lépésben katalizátorként általában valamilyen fém-komplexet használnak.
- CH3OH + HI → CH3I + H2O
- CH3I + CO → CH3COI
- CH3COI + H2O → CH3COOH + HI
Acetaldehid oxidációja
szerkesztés- 2 CH3CHO + O2 → 2 CH3COOH
Etilén oxidációja
szerkesztés- H2C=CH2 + O2 → CH3COOH
Jegyzetek
szerkesztés- ↑ a b c Az ecetsav (ESIS)[halott link]
- ↑ Az ecetsav vegyülethez tartozó bejegyzés az IFA GESTIS adatbázisából. A hozzáférés dátuma: 2010. november 21. (JavaScript szükséges) (angolul)
- ↑ Magyar Dietetikusok Országos Szövetsége: Tudta-e az ecetről? (2016)
- ↑ MAGYAR ÉLELMISZERKÖNYV: 2-109számú irányelv - Kézműves/kézmívesélelmiszerek általános jellemzői
További információk
szerkesztés- Savanyúság.lap.hu – linkgyűjtemény
- Az ecetgyártás; szerk. Pándi Ferenc, Sólyom Lajos; Mezőgazdasági, Bp., 1982
- Thönges, Heinrich: Gyümölcslevek, gyümölcsborok, ecet és likőrök házi készítése; ford. Seresi Frigyes; Hogyf Editio, Bp., 1999
- Anne Iburg: Olajok és ecetek kislexikona. Eredetük, ízük, felhasználásuk receptekkel; ford. Haynal Katalin; Mérték, Bp., 2006
- Petra Teetz: Ecetek és olajok; ford. Gulázsi Aurélia; Cser, Bp., 2008 (Házi praktikák)
- D. C. Jarvis: Az almaecet és a méz. Egy orvos életműve: kísérletek, tanulmányok. A természet titkaiból; Hunagro Holding, Kaposvár, 2011
- Élisabeth Andréani–Françoise Maitre: Az ecet titkai; ford. Sediánszky Nóra; Sziget, Bp., 2016
- Ambrus Lajos–Kovács Gyula–Lugosi József: Kincsünk, az ecet; Együtt a Jövőért Egyesület, Zalaegerszeg, 2023