Vegyértékelektronpár-taszítási elmélet
A vegyértékelektronpár-taszítási elmélet (angol betűszóval VSEPR-elmélet) egy modell a kémia területén, amely segít előre jelezni az egyes molekulák geometriáját a központi atomjaikat körülvevő elektronpárok alapján.[1] Gillespie–Nyholm-elméletnek is nevezik az elmélet két fő kidolgozója, Ronald Gillespie és Ronald Nyholm után.
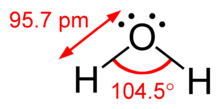
Az elmélet legfontosabb tétele, hogy az adott atom körüli vegyértékelektron-pár tagjai egymás kölcsönös taszítása miatt úgy rendeződnek el, hogy minimalizálják ezt a taszító hatást. Ebből következik, hogy a molekula energiája csökken, stabilitása pedig nő, ez pedig nagyban meghatározza a molekuláris geometriát. Gillespie hangsúlyozta, hogy a molekuláris geometria meghatározásához fontosabb a Pauli-elvből adódó elektron-elektron taszítás, mint az elektrosztatikus taszítás.[2]
Az elmélet inkább a megfigyelhető elektronsűrűségen alapul, mintsem a matematikai hullámfüggvényeken, ezért független a pályák hibridizációjától,[3] bár ezen utóbbi elmélet fókuszában is a molekulák alakja áll.
Története
szerkesztésAz ötletet, hogy korreláció van a molekuláris geometria és a vegyértékelektron-párok között, eredetileg Ryutaro Tsuchida vetette fel 1939-ben, Japánban,[4] de később, ettől függetlenül egy Bakeri Előadás során Nevil Sidgwick és Herbert Powell is a nyilvánosság elé tárta.[5] 1957-ben Ronald Gillespie és Ronald Sydney Nyholm tovább finomította ezt a koncepciót egy részletesebb elméletté, amely már megadta a különböző alternatív geometriák közüli választás lehetőségét.[6][7]
Az utóbbi időkben a teóriát több kritika is érte, melyek szerint a tudományos pontosság és a pedagógiai értékek szempontjából az elmélet már idejétmúltnak számít.[8] A kritikák egyik tárgya, hogy a vízmolekula és a karbonilvegyületek egyenértékű, nemkötő elektronpárjai alapvető különbségeket hagynak figyelmen kívül a molekulapályák és az ezeknek megfelelő természetes kötőpályák szimmetriájában, mely különbségek esetenként fontosak lehetnek kémiailag. Ezen felül pedig kevés kísérleti és számításalapú bizonyíték van arra nézvést, hogy a nemkötő elektronpárok „nagyobbak” lennének a kötő párjaiknál.
Felmerült az az elgondolás is, hogy a Bent-szabály (mely egy egyszerű modell a molekuláris szerkezet leírására) alkalmas lenne a vegyértékelektronpár-taszítási elmélet kiváltására.
Mindezek ellenére a VSEPR-elmélet jól írja le az egyszerűbb molekulák alapvető strukturális és elektroneloszlási tulajdonságait, és a legtöbb helyen az egyetemi képzések során továbbra is tanítják.
AXE módszer
szerkesztésAz elmélet alkalmazásához az elektronokat általában az „AXE-módszer” szerint számolják. A központi atom körül az elektronpárokat az AXnEm képlettel jelölik, ahol A a központi atom, és mindig 1-es indexszel szerepel. X az egyes ligandumokat (az A-hoz kapcsolódó atomokat), E pedig a központi atom nemkötő elektronpárjait jelöli.[9] Az X-ek és E-k számának összege (n + m) a sztérikus szám. Az AX3E2 molekulában például az A atom sztérikus száma 5.
A sztérikus szám, valamint X és E értékeinek függvényében az elmélet az alábbi táblázat szerinti térszerkezeteket jósolja. Megjegyzendő, hogy a térszerkezet neve csak az atomok, és nem az elektronok elrendeződését tükrözi – így például az AX2E1 V-alakja azt jelenti, hogy az AX2 három atomja nem egy egyenesre esik.
| Sztérikus szám |
A molekula térszerkezete[10] 0 nemkötő pár |
A molekula térszerkezete[10] 1 nemkötő pár |
A molekula térszerkezete[10] 2 nemkötő pár |
A molekula térszerkezete[10] 3 nemkötő pár |
|---|---|---|---|---|
| 2 | lineáris (CO2) |
|||
| 3 | sikháromszöges (BCl3) |
V alakú (SO2) |
||
| 4 | tetraéderes (CH4) |
trigonális piramisos (NH3) |
V alakú (H2O) |
|
| 5 | trigonális bipiramisos (PCl5) |
„mérleghinta” alakú (SF4) |
T alakú (ClF3) |
lineáris (I−3) |
| 6 | oktaéderes (SF6) |
tetragonális piramisos (BrF5) |
síknégyszöges (XeF4) |
|
| 7 | pentagonális bipiramisos (IF7)[11] |
pentagonális piramisos (XeOF−5)[12] |
síkötszöges (XeF−5)[13] |
|
| 8 | ||||
| 9 | háromszorosan fedett trigonális prizma (ReH2−9)[14] |
| Molekula típusa |
Térszerkezet[10] | Elektronok elrendeződése[10] (beleértve a halványsárgával jelölt nemkötő elektronpárokat is) |
Elektronok elrendeződése[10] (nemkötő párok nélkül) |
Példák |
|---|---|---|---|---|
| AX2E0 | BeCl2,[1] HgCl2,[1] CO2[11] | |||
| AX2E1 | NO−2,[1] SO2,[10] O3,[1] CCl2 | |||
| AX2E2 | H2O,[10] OF2[15] | |||
| AX2E3 | XeF2,[10] I−3,[16] XeCl2 | |||
| AX3E0 | BF3,[10] CO2−3,[17] NO−3,[1] SO3[11] | |||
| AX3E1 | NH3,[10] PCl3[18] | |||
| AX3E2 | ClF3,[10] BrF3[19] | |||
| AX4E0 | CH4,[10] PO3−4, SO2−4,[11] ClO−4,[1] XeO4[20] | |||
| AX4E1 | SF4[10][21] | |||
| AX4E2 | XeF4[10] | |||
| AX5E0 | PCl5[10] | |||
| AX5E1 | ClF5,[22] BrF5,[10] XeOF4[11] | |||
| AX5E2 | XeF−5[23] | |||
| AX6E0 | SF6,[10] WCl6[24] | |||
| AX6E1 | XeOF−5,[12] IOF2−5[12] | |||
| AX7E0 | IF7[11] | |||
| AX8E0 | IF−8, ZrF4−8, ReF−8 | |||
| AX9E0 | ReH2−9[25] |
Ha a(z A) központi atomhoz különböző (X) atom(ok) kapcsolódnak, akkor is közelítőleg a fenti térszerkezet érvényes, de a kötésszögek ilyenkor némileg eltérhetnek attól, mint amikor a kapcsolódó atomok azonosak. Például az alkének – mint a C2H4 – kettős kötésű szénatomja AX3E0 típusú, de a kötésszögek nem pontosan 120°-osak. Hasonló az AX3E1 szerkezetű SOCl2 esete is: mivel az X szubsztituensek nem egyformák, az X−A−X szögek sem mind egyenlőek.
Jegyzetek
szerkesztés- ↑ a b c d e f g Jolly, W. L.. Modern Inorganic Chemistry. McGraw-Hill, 77–90. o. (1984). ISBN 978-0-07-032760-3
- ↑ Gillespie, R. J. (2008). „Fifty years of the VSEPR model”. Coord. Chem. Rev. 252 (12–14), 1315–1327. o. DOI:10.1016/j.ccr.2007.07.007.
- ↑ Gillespie, R. J. (2004), "Teaching molecular geometry with the VSEPR model", Journal of Chemical Education 81 (3): 298–304, DOI 10.1021/ed081p298
- ↑ Tsuchida, Ryutarō (1939). „A New Simple Theory of Valency” (japanese nyelven). Nippon Kagaku Kaishi 60 (3), 245–256. o. DOI:10.1246/nikkashi1921.60.245.
- ↑ Sidgwick, N. V., H. M. Powell (1940). „Bakerian Lecture. Stereochemical Types and Valency Groups”. Proc. Roy. Soc. A 176 (965), 153–180. o. DOI:10.1098/rspa.1940.0084.
- ↑ Gillespie, R. J., R. S. Nyholm (1957). „Inorganic stereochemistry”. Q. Rev. Chem. Soc. 11 (4), 339. o. DOI:10.1039/QR9571100339.
- ↑ Gillespie, R. J. (1970). „The electron-pair repulsion model for molecular geometry”. Journal of Chemical Education 47 (1), 18. o. DOI:10.1021/ed047p18.
- ↑ Clauss, Allen D. (2014. október 8.). „Rabbit-ears hybrids, VSEPR sterics, and other orbital anachronisms” (angol nyelven). Chem. Educ. Res. Pract. 15 (4), 417–434. o. DOI:10.1039/c4rp00057a. ISSN 1756-1108.
- ↑ General Chemistry: Principles and Modern Applications, 8th, Prentice-Hall, 410–417. o. (2002). ISBN 978-0-13-014329-7
- ↑ a b c d e f g h i j k l m n o p q r s General Chemistry: Principles and Modern Applications, 8th, Prentice-Hall, 413–414 (Table 11.1). o. (2002). ISBN 978-0-13-014329-7
- ↑ a b c d e f g h i Miessler, G. L., D. A. Tarr. Inorganic Chemistry, 2nd, Prentice-Hall, 54–62. o. (1999). ISBN 978-0-13-841891-5
- ↑ a b c (2000) „Mean amplitudes of vibration of the pentagonal pyramidal XeOF−5 and IOF2−5 anions”. J. Fluorine Chem. 101, 61–63. o. DOI:10.1016/S0022-1139(99)00194-3.
- ↑ Housecroft 498 o.
- ↑ Housecroft 254 o.
- ↑ Housecroft 448 o.
- ↑ Housecroft 483 o.
- ↑ Housecroft 368 o.
- ↑ Housecroft 407 o.
- ↑ Housecroft 481 o.
- ↑ Housecroft 499 o.
- ↑ Housecroft 45 o.
- ↑ Housecroft 481 o.
- ↑ Housecroft 498 o.
- ↑ Housecroft 659 o.
- ↑ Housecroft 254 o.
Fordítás
szerkesztésEz a szócikk részben vagy egészben a VSEPR theory című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Források
szerkesztés↑ Housecroft Housecroft, C. E., A. G. Sharpe. Inorganic Chemistry, 2nd, Pearson (2005. december 8.). ISBN 978-0-130-39913-7