Aszkorbinsav
| Aszkorbinsav | |
| |

| |
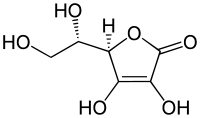
| IUPAC-név | (R)-3,4-dihidroxi-5-[(S)-1,2-dihidroxietil]furán-2(5H)-on |
| Más nevek | C-vitamin |
| Kémiai azonosítók | |
|---|---|
| CAS-szám | 50-81-7 |
| ATC kód | A11GA01, G01AD03 S01XA15 |
| Gyógyszer szabadnév | ascorbic acid |
| Gyógyszerkönyvi név | Acidum ascorbicum |
| Kémiai és fizikai tulajdonságok | |
| Kémiai képlet | C6H8O6 |
| Moláris tömeg | 176,13 g/mol |
| Megjelenés | fehér vagy sárga szilárd anyag |
| Sűrűség | 1,65 g/cm³ |
| Olvadáspont | 190–192 °C (bomlik) |
| Oldhatóság (vízben) | oldható |
| Savasság (pKa) | 4,10 (primer); 11,6 (szekunder) (25 °C-on) |
| Veszélyek | |
| EU osztályozás | nincsenek veszélyességi szimbólumok[1] |
| R mondatok | (nincs)[1] |
| S mondatok | (nincs)[1] |
| LD50 | 11900 mg/kg (patkány, szájon át)[1] |
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |
- Ez a cikk az aszkorbinsav kémiai tulajdonságait tárgyalja. A táplálkozási szempontokat a vitaminok cikk tartalmazza.
Az aszkorbinsav egy antioxidáns tulajdonságú szerves sav. Fehér vagy világossárga kristályok formájában jelenik meg. Az aszkorbinsav L-enantiomere más néven C-vitamin. A név eredete: a- fosztóképző és scorbuticus (=skorbut) mivel a molekula hiánya az emberi szervezetben skorbuthoz vezethet. Élelmiszer-adalékanyagkénti azonosítója E300.
Az aszkorbinsav cukorszármazéknak tekinthető, az L-aszkorbinsav a 2-dezoxi-2-keto-L-gulonsav γ-laktonjának en-diol-alakjának tekinthető. Vízben jól oldódik. Optikailag aktív vegyület, jobbra forgat.
Története
szerkesztésA C-vitamin hiányakor kialakuló betegség, a skorbut, az egyik legrégebben ismert hiánybetegség, már a 16. század elején leírták. Ez a betegség nagy pusztításokat okozott háborúk és éhínségek idején, illetve a hajósnépeknél. Egyes hajósnépek felismerték, hogy a gyümölcsöt is tartalmazó étrend a hosszú hajóutakon segít a skorbut megelőzésében. Csak 1912-ben tengerimalacokon végzett kísérletek során sikerült igazolni, hogy a skorbut valóban hiánybetegség. 1920-ban C-vitaminnak nevezték el azt a tápanyagkomponenst, amelynek hiánya a skorbutot okozza.
1937-ben Norman Haworth kémiai Nobel-díjat kapott az aszkorbinsav szerkezetének meghatározásáért (megosztva Paul Karrerrel, aki a vitaminokat kutatta), és ugyanebben az évben az orvosi Nobel-díjat Szent-Györgyi Albert kapta, aki a C-vitamin biológiai hatásait tanulmányozta. Az 1920-as években, mikor felfedezték, néhányan még hexuronsavnak nevezték.[2]
Szerkezete, kémiai tulajdonságai
szerkesztésEgyértékű savként viselkedik. Erős redukálószer. Nemcsak a Fehling-oldatot redukálja, savas kémhatású vizes oldatban az ezüstionokat ezüstté, a jódot jodidionokká alakítja. Redukció során maga az L-aszkorbinsav dehidro-L-aszkorbinsavvá oxidálódik.
L-aszkorbinsav |
dehidro-L-aszkorbinsav |
Enyhe oxidációja dehidro-L-aszkorbinsavvá reverzíbilis, mivel a keletkezett vegyület redukcióval visszaalakítható L-aszkorbinsavvá. A dehidro-L-aszkorbinsav erélyes oxidációkor tovább oxidálódhat, az ilyen folyamatok (például a bomlása oxálsavra és L-treonsavra) viszont már irreverzibilisek. Az enyhe oxidációkor képződő dehidro-L-aszkorbinsav nem redukáló hatású és nem mutat savi jelleget. Az L-aszkorbinsav öttagú laktongyűrűt tartalmaz, ami feltűnően stabil, még tömény lúgok hatására sem hasad fel. Ez viszont a dehidro-L-aszkorbinsav laktongyűrűjére nem igaz.
Az L-aszkorbinsav en-diol -szerkezetű. Azért hajlamos enolizációra, mert egyrészt a molekula ekkor két szomszédos karbonilcsoportot tartalmazna, ami a molekulát instabillá tenné, másrészt így kialakulhat egy stabilizáló intramolekuláris hidrogénkötés. Savjellege és redukáló tulajdonsága egyaránt az en-diol -szerkezetével magyarázható. Az enolok a fenolokhoz hasonlóan erősebb savak, mint az alkoholok, az en-diolok pedig a kétértékű fenolokhoz hasonlóan redukáló tulajdonságúak (a kétértékű fenolok kinonokká oxidálódhatnak). A vegyület egyértékű savjellegét az okozza, hogy úgynevezett α,β-telítetlen oxovegyület. A lakton-részlet karbonil-funkciójának −I (elektronszívó) effektusa a karbonilcsoporthoz képest β-helyzetű szénatomon érvényesül. Ezért a hidroxilcsoport hidrogénje könnyebben disszociál, mint egy normál alifás alkohol OH-csoportjának hidrogénje.
Biológiai szerepe
szerkesztésA C-vitamin a kötőszöveti rostok egyik típusának, a kollagénnek az előállításához nélkülözhetetlen koenzim. A kötőszövet sejtjein belül a prokollagén fehérje különböző poszttranszlációs módosulásokon megy keresztül, majd a molekula prolin és lizin oldalláncai hidroxilálódnak (hidroxiprolin, hidroxilizin), majd a polipeptidlánc glikozilálódik. A hidroxilálás csak C-vitamin jelenlétében tud lezajlani, vagyis C-vitamin hiányában a szervezet nem tud kollagént, és így jó minőségű kötőszövetet létrehozni. A C-vitamin hiánybetegsége a skorbut, ennek tünetei (a fogak meglazulása-elvesztése, ínysorvadás, nyálkahártya-vérzékenység) is a kollagénképzés zavarából adódnak.
Előfordulása
szerkesztésAz L-aszkorbinsav megtalálható mind a növényi, mind az állati szervezetben. Egyes növények aszkorbinsav-tartalma különösen nagy. Száz gramm csipkebogyó például körülbelül 400 mg, a fenyőtű 200, a petrezselyemlevél 185, a paradicsompaprika 180, a zöldpaprika 125, a káposzta 87, a barack 50, a citrom 45, a nyers burgonya 24 mg aszkorbinsavat tartalmaz.
Előállítása
szerkesztésAz 1920-as évek végén Szent-Györgyi ismeretlen anyagot talált a mellékvesében. Megállapította összetételét (C6H8O6), és hexuronsavnak nevezte el (1928). Hazatérve, Szegeden olyan növényi forrást keresett, melyből nagyobb mennyiségben lehet kivonni hexuronsavat. Erre a célra a szegedi paradicsompaprika kiválóan megfelelt: 10 liter présnedvből 6,5 gramm hexuronsavat állítottak elő. 1932-ben Szent-Györgyi – és tőle függetlenül Josef Tillmans – a hexuronsavat azonosította a C-vitaminnal. Javaslatára a hexuronsavat a skorbut elleni hatásra utalva aszkorbinsavnak nevezték el. Szegeden a paprikából kiinduló C-vitamin gyártás módszerét is kidolgozták.(Nobel-díját részben ezért kapta , 1937-ben.)
A C-vitamin első szerkezetbizonyító szintézisét két kutatócsoport (Tadeus Reichstein és munkatársaik, illetve Norman Haworth, Edmund Hirst és munkatársaik) egyidejűleg valósította meg, elvileg azonos módon. Ez a szintézis L-xilózból indult ki, amit L-xiloszonná alakítottak. Ezt nyomnyi mennyiségű kálium-cianidot tartalmazó hidrogén-cianiddal imino-L-aszkorbinsavvá alakították (ez a termék az L-xiloszon és a hidrogén-cianid reakciójában képződő L-xiloszon-ciánhidrin átrendeződése során képződött). Az imino-L-szorbinsav savas hidrolízisével nyerték az L-aszkorbinsavat. Ez a szintézis ma már nem használatos, mivel a hozam gyenge, és az alapanyag, az L-xilóz drága. Ez a szintézis csak azért volt fontos, mert szerepet játszott az L-aszkorbinsav szerkezetének felderítésekor.
Az aszkorbinsav gazdaságosan előállítható a Reichstein és Grüssner Endre által 1936-ban kidolgozott szintézissel, ami még ma is használatos. Ez a szintézis a legolcsóbb cukorból, a D-glükózból indul ki. Ezt először hidrogénezéssel szorbittá telítik, majd ezt mikrobiológiai oxidáció segítségével L-szorbózzá alakítják. Ennek hozama 60%. Az L-szorbózt acetonnal 2,3-4,6-diaceton-L-szorbózzá kondenzálják, majd ennek hidroximetil-csoportját kálium-permanganáttal karboxilcsoporttá oxidálják. Ekkor 2,3-4,6-diaceton-2-keto-L-gulonsav képződik. Ha ennek a vegyületnek a vizes oldatát rövid ideig melegítik, a védőcsoportok az oldat saját aciditása folytán lehidrolizálnak. Az ekkor képződő 2-keto-L-gulonsavat sósav jelenlétében melegítik. Ekkor enolizáció történik és a γ-laktongyűrű kialakul, aszkorbinsav képződik. A szintézis legkényesebb lépése a 2-keto-L-gulonsav aszkorbinsavvá alakítása. A szintézisre emiatt két változatot dolgoztak ki, ekkor a 2-keto-L-gulonsav 53%-os hozammal alakítható L-aszkorbinsavvá, és 100 gramm glükózból 20-30 g aszkorbinsav nyerhető.
Kapcsolódó szócikkek
szerkesztésJegyzetek
szerkesztés- ↑ a b c d Az aszkorbinsav vegyülethez tartozó bejegyzés az IFA GESTIS adatbázisából. A hozzáférés dátuma: 2011. január 16. (JavaScript szükséges) (angolul)
- ↑ Joseph Louis Svirbelf, Albert Szent-Gyorgyi The Chemical Nature Of Vitamin C, April 25th, 1932. Part of the National Library of Medicine collection. Accessed January 2007
További információk
szerkesztés- Hány milligrammtól lehet veszélyes a C-vitamin fogyasztása? – Origo, 2010. november 17.
- Mennyi C-vitaminra van szükségünk? - gyogynovenyek.info
- Az aszkorbinsav és C-vitamin közti különbség Archiválva 2021. június 9-i dátummal a Wayback Machine-ben