Tokotrienol
A tokotrienolok (eng: tocotrienol; görög: tokosz: gyerekszülés, trién: három kettős kötést, -ol: -OH) E-vitamin izomerek, tokoferolok, a zsíroldékony vitaminok (lipovitamin) csoportjába tartozó, kis molekulájú, biológiailag aktív, szerves, növényi vegyületek, amelyeknek négy fajtáját különböztetjük meg (α-, β-, γ-, δ-tokotrienol).[1][2] Az E-vitamin tokotrienol formában negyvenszer erősebb és hatékonyabb bizonyos betegségek helyreállításában, ezért "High Potency" E-vitaminnak is nevezik (magas potenciájú természetes E-vitamin).[3] A 21. század E-vitaminjának nevezte a Biochemical Pharmacology című tudományos folyóirat.[4][5]
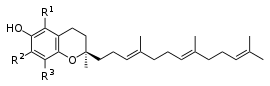







Az E-vitamin-család két alcsoportra: tokotrienolokra (T3) és a tokoferolokra (TP) osztható kémiai szerkezetük alapján.[6] A tokol alapváz, 2-metil-2-alkil-6-hidroxi-krománnak[7] tekinthető. A tokotrienolok molekuláris struktúrája hasonló a tokoferolokéhoz, azzal a különbséggel, hogy az izoprenoid oldallánc három telítetlen kettős kötést tartalmaz. A tokoferolok kémiailag a benzopiranolok csoportjába tartoznak, a fenolos gyűrűn egy, két, vagy három metilcsoporttal. A pirán-gyűrűhöz egy 16 szénatomos lánc (izoprén) kapcsolódik, amely a tokoferolok esetében telített, a tokotrienolok esetében háromszorosan telítetlen.[8] A természetes tokoferolok fitil oldallánca három királis centrummal rendelkezik, melyeknek RRR konfigurációja van. A tokotrienolok természetes vegyületek, amelyek növényi olajokban, búzacsíra-, árpa-, fűrészpálmaolajban, zabban és bizonyos diókban és magvakban található.
Valamennyi formának önálló biológiai aktivitása van, mely a szervezetben megnyilvánuló hatásának a mértékét is meghatározza.[9] A tokotrienolok humánbiológiai hatásainak, valamint hatásmechanizmusainak kutatása, feltérképezése – különös tekintettel egyes tokotrienolok rákmegelőzésben betöltött szerepére – napjainkban számos kutatás tárgyát képezi.[10] A tokotrienolok az LDL-koleszterin káros hatását a termelődés csökkentésén keresztül, valamint egyfajta kompetitív hatás útján fejtik ki.[11] Jelenlegi ismereteink szerint a kardiovaszkuláris megbetegedések rizikó-tényezőjeként számba vett koleszterinnel kompetitív kapcsolatban vannak az emberi szervezetben való felszívódás tekintetében. Ennek megfelelően a megnövelt tokotrienol-bevitel csökkenti a koleszterin szintjét a vérben, ennek következtében a koleszterin jelentette kockázati tényezőt mérsékli.
A tokotrienolok farnezil-farok része teszi lehetővé a downregulációját a 3-hidroxi-3-metil-glutaril-koenzim-A-reduktáz enzimnek, amely lényeges szerepet játszik a koleszterin szintézisben. A hosszabb, fitilcsoport-farok kettős kötések nélküli része meggátolja a tokoferoloknál a hasonló funkciót. A HMG-CoA-reduktáz alulszabályozásánál már kimutatták, hogy csökkenti az össz- és LDL-koleszterin szintet, és amely magába foglalja a tokotrienolok daganatgátló képességét is.
1991-ben bebizonyították, hogy gátolják a sejtosztódást a proteinkináz-C aktivitás gátlásával. A β–szitoszterinnek a tumorsejtek fejlődésére gyakorolt hatását is tanulmányozták. Állatkísérletek során azt tapasztalták, hogy a β–szitoszterin és a kampeszterin meggátolta a PC-3 humán prosztatarákos sejtek burjánzását.[12]
Egészségre gyakorolt hatásaik
szerkesztés- erős antioxidánsok
- szerepet játszanak a koleszterinszint csökkentésében
- szerepet játszanak a tumorszuppresszióban
- szerepet játszanak az érelmeszesedés lassításában
- szerepet játszanak a szív részéről az oxidatív stressz okozta káros hatásainak kivédésében
- szerepük van a cukorbetegségben és más hormonok szabályozásban
- újabb kutatások foglalkoznak az angiogenezisre, a csontok egészségére, a gyomor elváltozásaira, a gyulladásra, az élet meghosszabbítására, és a bőr egészségére gyakorolt hatásaival.
Tokotrienolok felfedezése és története
szerkesztésBár az E-vitamint az alfa-tokoferol formájában az 1920-as években fedezték fel, de a tokotrienolok felfedezéséről először csak 1964-ben számoltak be Pennock és Whittle (USDA, Liverpool),[13] gumifából (Havea brasiliensis) izolálták.[14] Míg nem az 1960-as évek végén egyes kutatók úgy gondolták, hogy a tokotrienolok legyenek részei az E-vitamin családfának.[15] A biológiai jelentőségét a tokotrienoloknak egyértelműen meghatározta a korai 1980-as években az, amikor a koleszterinszintet csökkentő képességéről először számolt be Qureshi és Elson.[16] Az 1990-es években, a rákellenes tulajdonságai a tokoferoloknak és tokotrienoloknak kezdett kirajzolódni.[17][18]
Tokotrienolok kutatása
szerkesztésAz első 90 évben az E-vitamin kutatás termékeny és figyelemre méltó felfedezéseket tett, de az elmúlt évtizedekben, ami figyelmet kapott leginkább a biológiai és a mögöttes mechanizmusok az alfa-tokoferollal kapcsolatosak, ami ma már tudjuk, az egyik a nyolc E-vitamin izomer közül.[4] Jelenleg a nem-tokoferol E-vitamin molekula, a tokotrienol új kutatási magasságokat ért el, több mint egy harmada az E-vitamin tokotrienollal kapcsolatos kutatásnak 2009-ben jelent meg, az elmúlt 30 évet figyelembe véve. Míg a legtöbb E-vitamin kutatás az alfa-tokoferolra összpontosított, a tokotrienolokkal kapcsolatos tanulmányok száma kevesebb mint 1%-a az összes E-vitaminnal kapcsolatos kutatást figyelembe véve. Az utóbbi időben a tokotrienolok új tudományos elismerést szereztek, és közel 30%-a ezeknek szakértők által értékelt kutatási cikk, amelyek az elmúlt 4 évben születtek.[mikor?] A legelső tudományos értékű kiadvány a tokotrienolkutatással kapcsolatban a Tocotrienols: Vitamin E Beyond Tocopherols.[19] Preklinikai és klinikai szinten kutatják a tokotrienolok szupressziós hatását a gyulladásos transzkripciós faktornak (NF-kB), amely szorosan kapcsolódik a tumorigenezishez és a HMG-CoA-reduktáz gátlásához, az emlős DNS-polimerázokhoz és egyes protein-tirozin-kinázokhoz. A kutatások vizsgálják részletesen a molekuláris célpontokat a rák esetében, a csontreszorpcióban, a cukorbetegségben, szív-és érrendszeri, valamint idegrendszeri betegségekben.
Tokotrienolok növényi forrásai
szerkesztésBár a legtöbb növényi levelek és magok tartalmaznak tokoferolokat, tokotrienolok csak egy nagyon kis hányadában vannak jelen a növényekben (176 növényi speciesben).[20] Barrie Tan[21] kutató vegyész, számos tokotrienol kinyerésére tett kísérletet természetes forrásokból. Ezek közé a felfedezések közé tartozik a tokotrienolok pálmaolajból (1992), majd barnarizsből (1998), és végül annattóból (2002) történő kinyerésük. Az első tokoferol-mentes tokotrienolt az annatto babból sikerült 2005-ben kinyerni. Az annatto növény (latin: Bixa orellana) az Amazonas vidékéről származik és már használják ősidők óta az indiánok. A spanyol hódító, Francesco de Orellana, aki több tudományos expedíciót vezetett a perui és a brazil dzsungelekbe, fedezte fel a növényt még a 16. században.[22] Az annattót természetes színezék gyanánt vezették be az USA-ban körülbelül 160 évvel ezelőtt, és ma is használják az élelmiszeriparban világszerte. A "tokoferol-mentes" annatto tokotrienol azért fontos, mert a kutatások kimutatták, hogy az alfa-tokoferol meggátolja a tokotrienol előnyös hatásait.
Tokotrienolok széles körben elterjedtek, és megjelennek a növényekben:
Növény Mennyiség (mg/kg) Áfonya 1700 Pálmaolaj (piros) 400 Szőlőmag olaj 330 Rizskorpa olaj 300 Búzacsíra olaj 40
Előfordulásuk a növényi szervekben
szerkesztésMíg a tokoferolok mindenütt jelen vannak a növényekben és szinte az összes növényi részben, addig a tokotrienolok csak néhány növény-csoportban találhatók és szinte kizárólag magvakban és gyümölcsökben. A tokotrienolok jelenléte és eloszlása a vetőmagokban azt sugallják, hogy bizonyos funkciók eltérnek a tokoferolok levéllel kapcsolatos funkcióitól. Abban az esetben, ha a gabonafélék képesek termelni tokotrienolokat, ki lehetett mutatni a tokotrienol-specifikus prenil-transzferáz enzimet. Másrészt növényekben, melyekben általában nem halmozódnak fel a tokotrienolok, ki lehetett mutatni, hogy transzgenikus manipuláció után készítenek tokotrienolokat, ahol bioszintézis útvonal upstreamje a prenilezés lépése. Ezért a különböző növényi tokotrienol-csoportoknak a jelenlétével kapcsolatban több információ is bizonyításra vár. A tokotrienolok funkciói a növényekben nem világosak, és azok szövet-specifikus eloszlása sem a magokban.
Növényélettani funkcióik
szerkesztésStresszre adott válasz
szerkesztésA tokoferolok befolyásolhatnak fontos fiziológiai folyamatokat, mint például a csírázást, fotoasszimilátumok exportját, növekedést, a levél öregedésén túl, antioxidáns funkciókat a fotoszintetikus membránokban és szerepüket az abiotikus stresszre adott növényi válaszreakcióban. Bár a tokokromanol hiány nélkülözhető az érett növények bizonyos növekedési feltételeiben, mert aktiválnak alternatív védekezési mechanizmusokat, úgy tűnik, hogy különösen fontosak a növényi válaszokban súlyos foto-oxidatív stresszben, vagy amikor más védelmi mechanizmusok hiányoznak vagy rendellenesek. Mivel a tokoferolok fő szerepe a növényekben, hogy megkösse a káros szabad gyököket, emellett bármilyen stressz, ami a megnövekedett szabad gyök-termelést okoz, általában emeli a tokoferolok termelését is. A környezeti tényezőket, beleértve a könnyű stresszt, vízhiányt, UV-B sugárzást, só-stresszt és egyéb szennyezőanyagokat tekintjük oxidatív stresszoroknak, amelyek növelik a H2O2, szuperoxid gyökök (OH.), szingulett oxigén (1O2), vagy bármely más ROS-termelést.[23]
Sejtfunkciók
szerkesztésNövények fejlődése (csírázás, öregedés)
szerkesztésTokoferolok szerepet játszanak a levelek öregedésében úgy, hogy a kloroplaszt membrán integritását befolyásolják, az egyéb öregedéssel kapcsolatos géneket akkumulálják, a lipidperoxidáció és a másodlagos oxidációs termékek kialakulásának mértékét megszabják (jazmonsav).[24] Tokoferolok felhalmozódnak az endospermium alatti szeneszcenciában, hogy megvédjék a magot az oxidatív stressztől a csírázás fejlődése során.[25]
Sejtközi jelzés
szerkesztésAz antioxidáns aktivitásuk mellett fontos szerepük van a szignál transzdukció szabályozásában és a génregulációban. Tisztázatlan miért csak bizonyos növényi részekben találhatók tokotrienolok.[27]
Membrán stabilitás
szerkesztésTokoferolok képesek beágyazódni a lipid membránokon keresztül a hidrofób oldallánccal; a hidrofil fej a lipid-víz határfelület felé orientált.[28] Ezen túlmenően α-tokoferol esetében azt találták, hogy növelik a szükséges merevségét a sejtmembránoknak a koncentrációjuk szabályozásával, de a membrán merevség káros lehet az ion transzferre és más növényi funkciókra, különösen a fejlődésükre.[29]
Tokoferolok metabolikus funkciói
szerkesztésBioszintézis
szerkesztésCsak növények és egyes cianobaktériumok képesek szintetizálni E-vitamint, míg a legtöbb prokarióta és élesztőgomba nagyon kis mennyiségben, vagy semmit. Biokémiai és molekuláris vizsgálatok azt mutatják, hogy a tokoferoloknak és tokotrienoloknak azonos a bioszintézisük,[30] amely két módon valósul meg: nem-mevalonsav útvonalon és sikimisav útvonalon
Antioxidáns aktivitás és a degradáció
szerkesztésA tokokromanolok a legfontosabb lipofil antioxidánsok a növényekben és állatokban, és nagy valószínűséggel alapvető fontosságúak a növényi magvak életképességének fenntartásában.[31]
Tokotrienolok biológiai hasznosulása és metabolizmusa
szerkesztésFelszívódás
szerkesztésA tokotrienolok zsírban oldódó vitaminok, és így hasonló módon szívódnak fel, mint a zsírok élelmiszerekben a bélből. Tokotrienolok biológiailag hozzáférhetőek, és kimutatták, hogy a lipidben gazdag szervekben raktározódnak, beleértve a máj, agy, lép, tüdő, vese, szív szöveteit.[32] A tokoferolok az éhbélen keresztül passzív diffúzióval szívódnak fel és kerülnek a portális keringésbe.
Tokotrienolok által modulált molekuláris célpontok sejttípusonként
szerkesztésModuláció tokotrienollal különböző célokból transzkripció, transzláció, poszt-transzlációs vagy közvetlen interakción keresztül.
- apoptotikus szabályozók: Bax↑, Bcl-2↓, Bcl-xL↓, Bfl-1/A1↓, c-FLIP↓, IAP-1↓, IAP-2↓, Survivin↓, TRAF-1↓, XIAP↓
- citokinek: IFN-γ↓, IL-12↑, IL-6↓, IL-1↓, PF-4↓, TNF-α↓
- adhéziós molekulák: ICAM-1↓, VCAM-1↓, E-selectin↓
- enzimek
- növekedési faktorok: bFGF↑, VEGF↓, TGF-β↓, HER2/neu↓
- kinázok
- receptorok
- transzkripciós faktorok
- egyéb:
Fehérjék, amelyek közvetlenül kölcsönhatásba lépnek a tokotrienolokkal
szerkesztés- alfa-tokoferol transzfer fehérje
- glutation S-transzferáz P1-1
- src
- szteroid- és xenobitukum-receptorok
- HMG-CoA reduktáz
- alfa-tokoferol asszociált protein
- béta-ösztrogén receptor
- P-glikoprotein
- 12-lipoxigenáz
- humán szérumalbumin
Antioxidáns aktivitása a tokotrienoloknak
szerkesztésAntioxidáns aktivitás mérése
szerkesztés- lipidperoxidáció gátlásának mértéke
- reaktív oxigénszármazékok (ROS) termelésének aránya
- hő-sokk fehérje expressziójának koncentrációja
E-vitamin csoport tagjai scavenger molekulák
szerkesztésÚgy találták, hogy a delta-tokotrienol rendelkezik a legnagyobb antioxidáns tulajdonsággal a tokotrienol izomerek közül,[33] ami annak köszönhető, hogy csökkent a metiláció a kromanol gyűrűn, amely lehetővé teszi a molekulának, hogy sokkal könnyebben beépüljön a sejtmembránba.[34] Egy összehasonlító in vitro vizsgálat kimutatta, hogy a gamma- és delta-tokotrienol 4-szer hatékonyabb volt, mint a többi tokotrienol izomerek a scavenger peroxil gyökök szempontjából. A lipid-ORAC vizsgálatokban delta- és gamma-tokotrienoloknak voltak a legmagasabb értékei az összes antioxidáns E-vitamin izomerek közül, 5,5x illetve 3x nagyobb a hatékonyságuk az alfa-tokoferolnál. A delta- és gamma-tokoferol is erős antioxidáns. E-vitamint is tartalmazó keverékek esetén (tokotrienolok és tokoferolok) a magasabb koncentrációjú alfa-tokoferol arányoknál alacsonyabb antioxidáns aktivitást mértek.[35]
Az E-vitamin csoport tagjai scavenger molekulák, „csapdába ejtik” a szabad gyököket. Különböző szervek iszkémia-reperfúziós károsodásának kivédésére használják. Hatásukat a biológiai membránokban is kifejtik, gátolják a lipidperoxidációt.[36] A tokotrienolok hatékony peroxil-gyökfogó tulajdonságai révén megakadályozzák a membránokban és a plazma lipoproteinekben a szabad gyökök terjedését.[37]
A γ-tokotrienol védi a proximális tubulusokat az oxidatív stresszel szemben
szerkesztésOxidatív stressz az egyik fő oka a különböző vesebetegségeknek.[38] A γ-tokotrienol (GT3) véd a mitokondriális diszfunkciót okozó és a vese proximális tubulus sejteket (RPTC) károsító oxidáló szerekkel szemben.[39]
Tokoferol interakciója a tokotrienolokkal és ennek következményei
szerkesztésAz alfa-tokoferol gátolja a tokotrienolok élettani hatásait. Tokoferolok nem rendelkeznek a koleszterinszint-csökkentő képességgel.[40] Alfa-tokoferol többszörösen bizonyítottan csökkenti vagy zavarja a koleszterinszint-csökkentő hatását a tokotrienoloknak.[41] Hatásos koleszterincsökkentő készítmények 15% (vagy kevesebb) alfa-tokoferolt és 60% (vagy több), gamma-és delta-tokotrienolt tartalmaznak, míg hatástalan készítmények 20% (vagy több) az alfa-tokoferol és 45% (vagy kevesebb), gamma-és delta-tokotrienolt.[42][43] Ezen túlmenően, tokotrienolok jobban felszívódnak a szervezetben, mint a tokoferolok, és kimutatták, hogy az alfa-tokoferol megakadályozza a felszívódását és a szerv/ szöveti szállítását a tokotrienoloknak.[44]
Összefoglalva: az alfa-tokoferol közvetlenül gátolja tokotrienolok előnyös élettani hatásait:
- veszélyezteti a koleszterinszint-csökkentő hatásukat[45]
- rákos sejtek szaporodása fokozódhat tokotrienolok szedése ellenére[46]
- tokotrienolok felszívódásának gátlása[47]
- indukálja a tokotrienolok katabolizmusát[47]
Önmagában, az alfa-tokoferol potenciálisan:
- fokozza a korai lebontását (vagy break-le) a vényköteles gyógyszerek egy részének[48]
- növeli a koleszterint és a vérnyomást[49]
- növeli a prosztatarák kockázatát[50]
Szív-és érrendszeri hatásuk
szerkesztésÉrrendszeri öregedés szerkezeti és funkcionális változásai
szerkesztés- megnövekedett oxidatív stressz (O-2, A-II)
- megnövekedett tromboxán A2 (Tx A2) szint
- megnövekedett PAI-I (plazminogén aktivátorinhibitor-l) szint
- lecsökkent prosztaglandin (PGI) szint
- megnövekedett endotelin (ET-1) szint
- lecsökkent nitrogén-monoxid (NO) és endoteliális NO szintetáz (ENOS) szint
Monocita-endothel sejtadhézió és a vérlemezkék
szerkesztésTanulmányok kimutatták, hogy a tokotrienolok pozitívan befolyásolják a monocita-endotél sejtadhéziót és a vérlemezke-aggregációt. Más szóval, a tokotrienolok megakadályozhatják az artériák falának szűkületét és a vérrögök kialakulását, fontos eleme az optimális szív- és érrendszer egészséges működésének. Az egyik első lépése az ateroszklerózisnak, a zsírréteg kialakulása az artériákban, ami a keringő monocitáknak a megtapadásával kezdődik az endotéliumon. A tokotrienolokról bebizonyosodott, hogy csökkentik a celluláris adhéziós molekula expresszióját és a monocita sejt megtapadását.[51] Különösen, a delta-tokotrienol mutatta a legerősebb gátló hatást a monocitasejt tapadásának csökkentésében a tokoferol és más tokotrienol izomerekhez képest. A delta-és gamma-tokotrienol 60x- 30x erősebb, mint az alfa-tokoferol.[52] Azt gondolják, hogy ez a jelenség a VCAM-1 expressziójának gátlásán keresztül a delta-tokotrienolnak köszönhető.[52] Lényegében a delta-tokotrienol jelentősen csökkenti a "Velcro-hatást", a keringő monocitáknak az artériás fal közötti folyamatát, a folyamat ismert, a plakk kialakulását okozza.[53]
Tokotrienolok lehetséges, antitrombotikus hatásának másik oka, a tromboxán B2 szintézisének gátlása, ezáltal a vérlemezke IV. faktor plazmaszintje csökken, úgy, hogy csökkentik a foszfolipáz A2-aktivitását, amely gátolja az arachidonsav felszabadulását a sejt-membrán foszfolipidekből és bénítják transzkripciós aktivációját a ciklooxigenáz-enzimnek a ciklooxigenáz útvonalon.
Tokotrienolok csökkentik a koleszterin szintet
szerkesztésLDL-koleszterin szintet csökkentik a HDL-t növelik
szerkesztésTokotrienolok gátolják a koleszterin bioszintézisének sebességét meghatározó enzim, a béta-hidroxi-béta-metilglutaril-koenzim-A-reduktázt (rövidebb nevén HMG-CoA-reduktáz). Ez a hipokoleszterinémiás hatása a tokotrienol izoprenoid oldalláncának azon képessége, hogy növelik a farnezol celluláris koncentrációját. A farnezol a mevalonsavból származik, a HMG-CoA-reduktáz reakciójának terméke. A farnezol poszt-transzkripció útján elnyomja a HMG-CoA-reduktáz szintézisét és fokozza a proteolitikus katabolizmusát ezen enzimnek. Blokkolja a szterin feldolgozását szabályozó elem-kötő fehérjét (SREBP). Blokkolása a SREBP feldolgozásának befolyásolják a triglicerid szintézist (vagy csökkenés), amely fontos paraméter praediabeteses és diabetikus állapotokban. Ezek a farmakológiai hatásmechanizmusok eltérnek a sztatin gyógyszerek hipokoleszterinémiás (atorvasztatin, cerivasztatin, fluvasztatin, lovasztatin és pravasztatin) hatásától, mert ezek kompetitív inhibitorai az enzimnek. Gamma-tokotrienol és a delta-tokotrienol lényegesen aktívabb, mint az alfa-tokotrienol a HMG-CoA-reduktáz aktivitásának megszüntetésében.
- gátolják a koleszterin-észteráz aktivitását
- csökkentik a lipidperoxidációt és fokozták szuperoxid-diszmutáz aktivitást SHR-ben
- gátolják a HMG-Co-R-t, növeltik a HDL-t, csökkentik az LDL-t és a TC-t
- javítják a lipidprofilt, csökkentik a TG-t és növelték a HDL-C-t
- megerősített koleszterin-katabolizmus az LDLR és a HMG-CoA-szint növelésével
- fokozott ürítése a semleges szterineknek és epesavaknak a széklettel
- 3T3-L1 preadipocitákban szupresszálják az Akt foszforilációját
Koleszterin szintézis szabályozásának vizsgálatai
szerkesztésA koleszterin szintézis szabályozásának kutatása állat-kísérletekben és klinikai vizsgálatokban folyamatos. Étrend-kiegészítővel táplált (gamma- és delta-tokotrienol) csirkék a legnagyobb koleszterin-szint (32%-os össz- és LDL-66% koleszterin) csökkenést mutatták, míg az alfa-tokoferolnak nem volt koleszterin-csökkentő hatása. Ebben a vizsgálatban a HDL / LDL koleszterin arány 123-150%-kal javult. (A csirkék élettani funkciói képesek jól maszkírozni az emberi lipogén aktivitást és a koleszterin szint változást).[54]
Két nyílt klinikai vizsgálatban az éhezés utáni vérzsír értékét mérték étkezés előtt és után 2 hónapon keresztül annattóból származó tokotrienol (75 mg/nap) táplálék-kiegészítővel.[55] Mindkét csoportban a teljes koleszterin-szint 13%-ra csökkent, míg az LDL-koleszterin csökkenés 9-15%-os, a HDL-koleszterin emelkedés 4-7%-os volt. Tekintve, hogy a tokotrienolok a természetben előforduló vegyületek, ezek a számok nagyon biztatóak. Jól dokumentálható, hogy a receptköteles gyógyszerek csökkenthetik az LDL koleszterintet 15-30%-kal, de nem hatnak a HDL koleszterinszintre. Továbbá, a tokotrienoloknak nincs mellékhatásuk, a vényköteles gyógyszereknek van. Az LDL/HDL arány változás 12-21%. Ugyanebben a tanulmányban egy további előnyeként a delta-tokotrienolnál azt találták, hogy előnyösen támogatják az egészséges szervezet anyagcseréjét, ahol a triglicerid szintet 20-30%-kal csökkentették.
Egy másik Bristol-Myers Squibb tanulmányban azt találták, hogy miután 4 hetes gamma- és a delta-tokotrienol (100 mg/nap) kiegészítésű étrend a teljes koleszterintet 15-22%-kal csökkentette, és az LDL-koleszterin szint is 10-20%-kal csökkent.[56]
Ateroszklerotikus léziókat csökkentik
szerkesztésÉrelmeszesedés elismerten egy krónikus gyulladásos betegség, ami atheroma képződéssel jár. Az érelmeszesedéssel kapcsolatos szövődmény például a koronária artéria betegség (CAD). Ez endoteliális aktivációval és oxidatív stresszel jár együtt. Ezek fő kockázati tényezőket váltanak ki, mint a hypercholesterinaemia, amely jellemzően endoteliális monocita-sejt adhézióval, monocita beszivárgással a tunica intimába és szivacsbetétek képződésével a sejtekben, simaizom sejt proliferációval és extracelluláris mátrix lerakódás fibrózus zsírosodással jár együtt. Számos anti-atheroszklerotikus mechanizmust mutatnak a tokotrienolok, mint például az anti-oxidatív, gyulladáscsökkentő, anti-endothel aktiváció, endoteliális monocita sejtek kötődését gátló és lipidcsökkentő hatást.
A tokotrienolok lehetséges anti-atherogén hatása az alábbi farmakológia hatásokkal magyarázhatók. Erős anti-oxidánsok mind in vitro, in vivo. Ezek közé tartozik az LDL-oxidáció gátlása, elnyomása a HMG-CoA-reduktáz aktivitásának és a vérlemezke-aggregáció gátlása. További lehetséges mechanizmusok közé tartozik a tokotrienol-mediálta csökkentése a plazma apolipoprotein B-100 (apoB) szintjének, a lipoprotein(a) [Lp(a)] plazma szintek csökkentése. A magas apoB plazmaszint, valamint az Lp(a) kockázati tényezőnek tekinthető a koszorúér-betegségben. A tokotrienolok csökkentik a fehérje és gén expresszióját az adhéziós molekuláknak és proinflammatorikus citokineknek, amelyek az NFkB deaktiválásával és a megnövekedett eNOS expresszióval jár együtt a stimulált endoteliális sejtekben. Az adhéziós molekulák expresszióján keresztül például az ICAM-1-nek, VCAM-1-nek és a monocita sejtek tapadásának gátlása valósul meg.
Hipertóniát csökkentik
szerkesztésÚjabb állatkísérletek azt mutatták, hogy a tokotrienolok csökkentik a vérnyomást, csökkentik a plazma-és vérerek lipid-peroxid koncentrációját, valamint javítják a teljes antioxidáns státuszt.[57] A gamma-tokotrienolokról kimutatták, hogy csökkentik jelentősen a szisztolés vérnyomást, és a jobb nitrogén-oxid-szintáz aktivitást (NOS), amelyek egyaránt kritikus szerepet játszanak az esszenciális hipertónia patogenezisében.[58] Emberben, a tokotrienolok növelik az artériás akkomodációt és csökkentik a vérnyomást.[59]
Fejverőér-szűkület
szerkesztésA cerebrovaszkuláris betegségek mortalitása mind világviszonylatban, mind hazánkban a harmadik leggyakoribb halálok. A fenti kórképek 25–30%-ában közvetlen kórok a carotis-rendszer szűkülete, illetve okklúziója. Egy 4 éves vizsgálatban részt vevő betegek nyaki érelmeszesedése azt mutatta, hogy a tokotrienol-tokoferol kiegészítő kezelés miatt regresszió következett be a betegségben. A betegek 88%-ánál a carotis stenosis visszafejlődött vagy stabilizálódott. Érdekesség, hogy az összkoleszterin a kiegészítő kezelésben résztvevők csoportjában 14%-kal csökkent, az LDL-koleszterin 21%-kal a vizsgálat negyedik évében.[60]
Sztrók okozta károsodást megelőzik
szerkesztésMegfordítják artériás elzáródás folyamatát (carotis arteriosclerosis), ezáltal csökkentik a kockázati tényezőit a szív-és érrendszeri betegségeknek, mint például érelmeszesedésnek és a szélütésnek. Pálmaolaj alapú tokotrienolok az első természetes vegyületek, amelyek humán vizsgálatokban azt mutatják, hogy képesek, az érelmeszesedés folyamatát megfordítani. Orvosi humán kutatások kimutatták, hogy a betegeknél az igazolt nyaki érelmeszesedésben szenvedők 240 mg/nap pálmaalapú tokotrienolt fogyasztottak 18-36 hónapon át, csökkentette a koleszterin eredetű plakk nagyságát a carotisban, míg a placebo csoportban nem mutatott ilyen hatást. Pálmaalapú tokotrienolok védenek az ApoE-knockout egerek koleszterin felhalmozódásával szemben, ezáltal megelőzik az érelmeszesedést.
Anti-angiogén hatás
szerkesztésAngiogenezis azt jelenti, hogy újabb erek (hiányoznak a periciták) képződnek a már létező véredény-nyaláb szöveteiből, és alapvető fontosságú az életkorhoz kapcsolódó kóros állapotokban, így például a tumornövekedésben, Reumatoid artritiszben, és diabéteszes retinopátiában. A delta-T3 potens anti-angiogén aktivitással rendelkezik in vitro és in vivo kísérletekben. T3 gátolja növekedési faktor által indukált proliferációt, migrációt és a ércső kialakulását a humán köldökvéna endothelialis sejtekben. T3 gátolja a tumorsejtek által kiváltott angiogenezist egér dosal légzsák (DOS) vizsgálatában és a csirke chorioallantois membrán (CAM) vizsgálatában. T3 gátolja az aktiválását a növekedési faktor által indukált extracelluláris szignál-regulált kináznak, az Akt-nak (protein kináz B) és az endothelialis nitrogén-oxid-szintáznak (eNOS), amely downstream kapcsolódik a különböző növekedési faktor receptorokhoz. T3 elnyomja a foszforilációját a vaszkuláris 35 endothelialis növekedési faktor (VEGF) receptor 2-nek, és gátolja a hipoxia-indukált VEGF kiválasztást és az IL-8 expresszióját mRNS és fehérje szinten a rákos sejtekben. A T3 hatásos, mint a szabályozó növekedési faktor-függő jelátviteli endoteliális sejtekben, és mint egy anti-angiogén szer minimalizálva a tumor növekedését.[61]
Anyagcserében játszott szerepük
szerkesztésElhízás természetes gyógyszere
szerkesztésA delta-tokotrienol csökkenti a teljes zsírtömeget és haskörfogatot. A hasi zsírszövetet csökkenti, különösen a retroperitonealis és mellékhere zsírpárnát, csökkenti a zsigeri elhízási-indexet. In vivo vizsgálatok azt mutatják, hogy az α-tokotrienol és a γ-tokotrienol felhalmozódik a zsírszövetben. Továbbá egy tanulmány beszámol arról, hogy meg van annak a lehetősége, hogy a delta-tokotrienol lehet a csoportba tartozó tokotrienolok közül az antiadipogén vitamin, amely a tápanyag-közvetítette szabályozása révén a testzsír differenciálódásra hat. A lipidprofil javult, alacsonyabb lett a plazma teljes koleszterin-, NEFA- és TAG-szint, ami arra utal, hogy fokozott a lipolízise és a β-oxidációja a zsírsavaknak. A tokotrienolok megakadályozhatják az elhízást a preadipocitáknak az adipocitákba differenciálódásának gátlása révén. A tokotrienol elnyomja az inzulin-indukált mRNS expresszióját az adipocita-specifikus géneknek, mint például a PPAR-γ-t, az adipocita zsírsav-kötő fehérjét (aP2) és a CCAAT/enhancer-kötő fehérje-α-t (C/EBP-α), amely gátolja a 3T3-L1 differenciálódását adipocitákba a preadipocitákból, inzulin jelenlétében.[62]
Továbbá a tokotrienolok csökkentik a máj triglicerid- és VLDL-szekrécióját. A természetes pálmaolajból nyert tokotrienolok a triglicerid szintet 28 százalékkal csökkentették a vérben két hónapi alkalmazás után. A tokotrienollal kezelt betegek kettős vak, placebo-kontrollált humán vizsgálatai kimutatták, hogy csökkenő tendenciát mutatott az átlagos testsúly, a testzsír tömege, a testzsír aránya és a derékbőség.[63] Blokkolja a szterin feldolgozását szabályozó elem-kötő fehérjét (SREBP). Blokkolása a SREBP (SREBP1,2, és DGAT2 APOB100) feldolgozásának, amelyek befolyásolják a triglicerid szintézist.
Kardiometabolikus előnyei
szerkesztésAz ún. fejlettebb országokban a lakosság jelentős része elhízott. Az ún. fejlődő országokban a lakosság jelentős része éhezik. A kardiometabolikus szindróma önmagában és minden részbetegsége külön-külön az életmód-betegségek csoportjába tartoznak. Azaz modern életmódunk károsító hatásai jelentősen növelik kialakulásuk kockázatát. A kardiometabolikus szindróma a modern társadalom egyik legnagyobb egészségügyi problémájává nőtte ki magát: magasvérnyomás, cukorbetegség, érelmeszesedés, elhízás. Számos klinikai vizsgálat metabolikus szindrómában és diabéteszben a tokotrienolokról kimutatta, hogy csökkentik a betegséghez társult tüneteket. A lipid profilt javítják, csökkentik a vércukorszintet, normalizálják a vérnyomást, csökkentve a kardiális erek rossz tulajdonságait és csökkentik a szív és a máj a gyulladásos infiltrációját. Vízoldható rizskorpa (270ppm az > 90% tokotrienolok) csökkentette az emelkedett vércukorszintet, glikált hemoglobin (glikált hemoglobin vagy közismert nevén a hemoglobin á-egy-cé, azaz a HbA1c) és a megnövekedett inzulin szintet, míg a zsírban oldódó rizskorpa rost (30ppm a> 90% tokotrienolok) csökkentette a hiperlipidémiát mind az 1-es és 2-es típusú cukorbetegeknél.
Egy másik nagy klinikai vizsgálatban, az E-vitamin bevitel csökkentette a kockázatát 2-es típusú cukorbetegségnek. A 2. típusú cukorbetegségben szenvedő betegek érelmeszesedésének progresszióját gyorsabb, és 80%-a a betegeknek érelmeszesedéses esemény következtében hal meg. Tokotrienoloknek nincs ismert mellékhatása, kimutatták, hogy csökkentik a szérum lipidek szintjét összesen 23%-kal, a teljes koleszterin szintet 30%-kal, és az LDL-koleszterin szintet 42%-kal (a 179 mg/dL 104 mg/dL) 60 napon belül 2-es típusú cukorbetegekben. Két nyitott tanulmány az éhomi vérzsírt mérte előtte és után 2 hónapon keresztül, annatto tokotrienollal (75 mg/nap). Mindkét csoportban a teljes koleszterin-szint 13%-ra csökkent, míg az LDL koleszterin 9-15%-ot csökkent, a HDL-koleszterin emelkedett 4-7%-kal. Az LDL/HDL arány csökkent 12-21%-ra. Fontos az anyagcsere egészségmegőrzése szempontjából, hogy a triglicerid szint 20-30%-ra csökkent.[64]
A tokotrienolok a metabolikus tünetegyüttes kezelésében:
- a T3 csökkenti a triglicerideket↓
- a T3 emeli a HDL↑
- a T3 csökkenti az LDL↓
- a T3 csökkenti a dibéteszes szimptómákat: HBP↓, arteriális copliance↑
Rák kemoprevenció
szerkesztésA tokotrienolok daganatcsökkentő hatással rendelkeznek. Tokotrienol-közvetítette növekedés szuppressziónak tulajdonítják a sejtciklus leállását többnyire a G1-fázisban és apoptózisban. A tokotrienolok elnyomják azokat a jelátviteli utakat, amelyek előmozdítják a sejtciklus progresszióját, növekedését, és a túlélését, beleértve a mitogén-aktivált protein kinázokat (MAPK), a Ras-t, a RhoA-t, a Raf/MAPK kinázt/ az extracelluláris szignál-szabályozott kinázokat, a c-Jun-t, c-myc-t, ciklin D/cdk4-t, a protein-kináz C-t, foszfatidilinozitol 3-kinázt, az Akt-ot, az IkB kinázt, az IkB-ét, a κB nukleáris faktort, a c-Jun N-terminális kinázt, a Bcl-2-t, a Bcl-xL-t, a COX-2-t, a mátrix metalloproteinázokat, vaszkuláris endotheliális növekedési faktort, a flipet és telomerázt. Ezzel szemben a tokotrienolok aktiválják a jelátviteli tevékenységet a növekedésben és az apoptózisban beleértve a p21cip1WAF1-t, a transzformáló növekedési faktor-β-át, a p53-at, a Fas-t, a Bax-t, az APAF-1-et, a kaszpázokat és a Bid fragmentációt.[65] A tokotrienoloknak sok lehetséges hatásmechanizmusa van a rák megelőzésére/ terápiájára, gátoljak a proliferációt és sejthalál indukálta rákbetegségeket. Egyes kutatók a rákellenes hatásukat:
- az antioxidáns aktivitásuknak (stabilizálják a szabad gyököket)[66]
- a HMG-CoA-reduktáz downregulációjának és /vagy degradációjának (géninterakciós mechanizmusokkal képesek a felelős enzimnek a "dial le" koleszterin termelését csökkenteni)[67]
- a kaszpáz-3 apoptotikus utak stimulálásának[67]
- a vaszkuláris endoteliális növekedési faktor (VEGF) gátlásának tulajdonítják (anti-angiogén mechanizmus érfalképződési mechanizmusok).[68]
Hasnyálmirigyrák
szerkesztésHasnyálmirigyrák továbbra is a legtöbb halálos esettel jár, 6%-os túlélési arány (körülbelül 20 betegből egy).[69] Egy I. fázisú, dóziseszkalációs vizsgálat, operálható hasnyálmirigyrákos betegeknél van folyamatban, és eddig nem mutatott káros mellékhatást a delta-tokotrienolt szedők legfeljebb 3200 mg/nap adagnál, míg a rákos sejtek apoptózisa megfigyelhető volt a legalacsonyabb adagnál, 200 mg/nap-nál is.[70] További szövetminták elemzését tervezik fázis II. vizsgálatban. Más sejtvonal és állat kísérletes tanulmányban, két egymástól független kutatócsoport egyértelműen állítja, hogy a delta-tokotrienol egyértelműen hatásosnak bizonyult a hasnyálmirigyrák kezelésében.[71]
Mellrák
szerkesztésTokotrienolokban gazdag frakciók (TRF), amely 43%-dezmetil tokotrienolokat tartalmazott, gátolta a humán, emlőrák sejtek szaporodását, míg az alfa-tokoferolnak nem volt hatása.[72] Egy másik tanulmány kimutatta, hogy a tokotrienolok gátolják a mellrák-független ösztrogén-receptorok működését. A leginkább hatásos inhibitorok a gamma- és delta-tokotrienol.[73]
Prosztatarák
szerkesztésDelta- és gamma-tokotrienolról kimutatták, hogy gátló hatással rendelkeznek többféle prosztatarák sejt vonalra tekintettel. Delta-tokotrienol indukálta leghatékonyabban a prosztatarák sejtvonal sejthalálát, valamint aktiválta a kaszpáz-független programozott sejthalált és megszakította a NFkB jelátvitelt.[74]
Melanoma
szerkesztésAz E-vitamin frakcióból legnagyobb koncentrációban a tokotrienolokat találtak a szubkután bőrrétegben, ami azt mutatja, hogy az alkalmazott hatóanyagok gyorsan áthatolnak a bőrön és ott raktározódnak, ezért hatékonyan képes védeni az UV vagy ózon indukálta bőrt az oxidatív stresszel szemben. Egerek erősen metasztatizáló melanomájában, gamma- és delta-tokotrienolok gátolták a melanoma sejteket in vitro, a nagy malignitású tumor visszafejlődött. Tokotrienolokkal kezelt állatokban hosszabb túlélést tapasztaltak. Gamma- és delta-tokotrienolt kombinálták a lovasztatinnal, még hatásossabb eredményeket produkáltak a melanoma sejtek szaporodásának gátlására vonatkozóan in vitro és in vivo körülmények között.[75]
Májdaganat
szerkesztésIn vivo és in vitro vizsgálatok kimutatták, hogy elnyomják a máj rákos burjánzását egerekben. Delta-tocotrienol hatékonyan apoptózist és S fázist felfüggeszti, miközben növeli a működését a CYPIAI génnek, az I. fázisú enzimnek.[76]
Tüdőrák
szerkesztésDelta-tokotrienol kezelés nem-kissejtes tüdőrák sejtek dózis- és időfüggő sejtnövekedés gátlást eredményezett, amelyet összefüggésbe hoztak a Notch-1 downregulációjával az NF-kB gátlás révén. Továbbá, egy alfa-tokotrienol analóg csökkentette a humán tüdő-adenokarcinómát Ras és Rho prenilezés elnyomásán keresztül. Egy nemrégiben in vivo és in vitro vizsgálat kimutatta, hogy elnyomják a tüdő rákos burjánzását egerekben. Delta-tokotrienol hatékonyan apoptózist és S fázist felfüggeszti, miközben növelik a működését a CYPIAI génnek, az I. fázisú enzimnek.[77]
Vastagbéldaganat
szerkesztésDelta-tokotrienolról kimutatták, hogy indukálja a paraptózis-szerű sejthalált az SW620 vastagbél-karcinóma sejtekben, amely a Wnt jelátvitellel kapcsolatos. Hasonlóképpen, a gamma-tokotrienol apoptózist indukált kaszpáz-3 aktiválásával a HT-29 típusú vastagbél-karcinóma sejtekben és humán gyomorrák sejtekben. Gyulladásos bélbetegségekben, például a Crohn-betegségben és a colitis ulcerosában is majdnem 20-szoros a növekedése a vastagbélrák kockázatának. A tokotrienolok gátolhatják a túlzott fibroblaszt szaporulatot, amelyek ezekhez a betegségekhez társulnak.[78]
Neurodegeneratív kórképekre gyakorolt hatásuk
szerkesztésA tokotrienolok és α-tokoferol ígéretes neuroprotektív hatást mutatott asztrocitákban és neuronokban glutamát toxicitásra adott válaszra. Közös-sejtkultúra modellekben bizonyított a szinergista hatás a neuronok és az asztrociták között glutamát toxicitás esetén.[79]
Alzheimer-kór
szerkesztésSúlyos demenciával és rokkantsággal járó tünetegyüttes, amelyet progresszív romlás jellemez az agy több kognitív területén. Az Alzheimer-kór előfordulása exponenciálisan emelkedik az életkorral. Oxidatív/ nitrozatív károsodás és gyulladás fontos szerepet játszik az Alzheimer-kór patogenezisében. Az α-, β-, γ-, δ-tokoferol, és az α-, β-, γ-, δ-tokotrienol potenciális neuroprotektív hatással rendelkezik. E-vitaminok jól oldódnak zsírokban, lánc-töréses, nem-enzimatikus antioxidánsok az emberi szervezetben, és fontos szerepet játszanak a normális neurológiai funkciók fenntartásában. Ezek a mikrotápanyagok elsődleges fontosságúak lehetnek az agy öregedésének befolyásolásában, mivel ez a szerv gyors anyagcserével rendelkezik és viszonylag kevés antioxidáns enzim védelme alatt áll. Két populáció alapú longitudinális vizsgálatban idősebb felnőtteknél (Kungsholmen Project CAIDE Study) azt találták, hogy kisebb az előfordulása a kognitív hanyatlásnak, valamint az Alzheimer-kóros alanyoknak magas a tokotrienol plazma szintje a tokotrienolok szedése mellett. Mindezek az eredmények indokolják a további vizsgálatokat az E-vitamin család korral összefüggő, kognitív hanyatlásra és az Alzheimer-kórra gyakorolt hatásukkal kapcsolatban.[80]
Parkinson-kór
szerkesztésSzklerózis multiplex
szerkesztésGyulladáscsökkentő hatás
szerkesztésA legerősebb gyulladásgátló hatású E-vitamin a delta-tokotrienol. Kiváltja a hormon és szteroid termelést, így közvetve csökkenti a gyulladást. Gátolja a gyulladásért felelős fehérjéket, ezzel közvetlenül is gátolja a gyulladást. Az emberi test 75 trillió sejtjét védik az oxidatív károsodástól, javítják az oxigén/szén-dioxid arányt a szervezetben.[81] A káros szabad gyök okozta szövetpusztulás megelőzésével képesek a gyulladást csökkenteni. A kapcsolatot a rák és a gyulladás között számos bizonyíték jelzi, az egyik a transzkripciós faktorok, NF-kB és STAT3, amelyek a két fő patobiokémiai útvonala a gyulladásnak és a ráknak. A tokotrienolok megszüntetik ezeket a gyulladásos utakat. A gyulladásgátló tulajdonságait mutatják tokotrienolok in vitro és in vivo vizsgálatokban. Rágcsáló (RAW 264.7) sejtekben és BALB/c nőstény egerekben a delta-tokotrienol erőteljesen kiváltott hormon és szteroid termelés mellett, csökkentik a TNF-alfát és a gátló proteaszóma 20S tevékenységet, jelezve a közvetett és közvetlen gyulladás gátlását.[82]
Erősen gátolják a gyulladásos válaszreakció markereit, mint például a kimotripszint, tripszint és a tumor nekrózis faktor-α-át (TNF-α). A vizsgálat eredményei kimutatták, hogy a tokotrienolok úgy működhetnek, mint egy erős proteaszóma modulátor, miközben növeli az immunrendszer ellenálló képességét a gyulladással szemben.[83] Egy másik vizsgálatban kimutatták, hogy hatékonyan csökkentik a nitrogén-monoxid és a tumor nekrózis faktor-α szinteket csirkékben.[84] A tokotrienolok COX-2 expressziójának down-regulációjában hatásosak, anélkül, hogy befolyásolnák a COX-takarító 1 enzimet, valamint hatékonyan csökkentik a gyulladáskeltő citokin, az IL-6 szintet.[85] Csökkentik az oldható fehérje expresszióját az IL-6-nak és az ICAM-1-nek. A delta-tokotrienol a leghatásosabb izomer a monocita kötő aktivitás gátlásában.[86] Kontrollálja az atherogén Lipoprotein a (Lp a) redukcióját[87] és bénítják az adhéziós ragasztó molekulákat.[88]
Radioaktív sugárzás elleni védelem
szerkesztésAz emberek a Föld háttérsugárzásának vannak kitéve minden nap. A sugárzás rendellenességet okozhat a sejtek növekedésében, amely egy olyan folyamat, ami rák kialakulásához vezethet. Általában alacsony dózisban az élő szervezetek képesek könnyen kijavítani a sugárzás okozta károsodást. Azonban a túl nagy dózisban érintett sejtek, szövetek elhalnak, a szervek nem. Az elmúlt hat évben az Amerikai Fegyveres Erők Sugárbiológiai Kutató Intézete (Armed Forces Radiobiology Research Institute, AFRRI, Bethesda, MD) kiterjedt kutatást végzett tokotrienolokkal kapcsolatban, mint radioaktív sugárzás elleni védő anyag. A tokotrienolokról megállapították állat-modelleken, hogy javítják a túlélést és csökkentik a radioaktív sugárzás okozta károsodást a szövetekben és szervekben teljes test besugárzás után. A delta- és gamma-tokotrienol a leghatékonyabb radioaktív sugárzás elleni szer a tokoferol izomerek közül. Delta- és gamma-tokotrienol egyértelműen serkentő hatású a vérképző szervek szöveteire, visszaállítva a friss vérképzését a károsodott őssejtekben.
Kísérleti egerek teljes test besugárzást követően, mind a delta- és gamma-tokotrienolok regenerálták a vér fehérvérsejtszámát az eredeti sejtszámra növelve, emellett a limfocitákat csak a delta-tokotrienol regenerálta. Tokotrienolok csaknem teljesen visszaállították a csontvelő őssejtjeit a normális szintre a besugárzást követően, míg a kezeletlen csontvelő kontroll teljesen kimerült maradt. Mindkét esetben a profilaktikus kezelés 24 órával a besugárzást megelőzően hatékonyabb volt, mint sugárkezelés után. Ezek az eredmények azt sugallják, hogy a delta- és gamma-izomerek alkalmasak lehetnek, mint erős radioprotektorok, elsőnek választandók nukleáris szennyezés, robbanás földrajzi területein dolgozók, radiológusok esetén, illetve sugárterápiában részt vevő betegek megelőző kezelésére. Azon kívül, hogy kiváló antioxidáns tulajdonságokkal bírnak a tokotrienolok, „potens radioprotektív” hatása abból ered, hogy képesek csökkenteni a nagyon reaktív oxidánsokat a vérben azáltal, hogy gátolják a HMG-CoA-reduktázt.[89][90][91][92][93][94]
Bőr regenerációjára, védelmére gyakorolt hatásai
szerkesztésAz E-vitamin multifunkcionális előnyei az elmúlt évtizedekben ismertté váltak. Egy antioxidáns, amely gyógyító és korrigáló tulajdonságokkal rendelkezik, amelyek segítenek megelőzni a bőr öregedését és bizonyos bőrdaganatokat.[95] Újabb vizsgálatok azonban azt találták, hogy a tokotrienolok sokkal hatásosabb E-vitamin (alfa-tokoferol) formájában fordul elő bizonyos növényi magvakban, mint például az olajpálma, amely kiváló antioxidáns aktivitást mutat.[96] A tokotrienolok speciális kémiai szerkezete biztosít egyedülálló biokémiai tulajdonságokat azért, hogy a bőr egészségét előnyösen befolyásolja antioxidáns tulajdonságán túl. Például, a kettős kötések a farnezil farkon, amely lehetővé teszi, hogy könnyen mozogjon a sejtek lipid membránján keresztül a molekula. Ez az eltérő kémiai szerkezet biztosítja celluláris felvételét biológiai rendszerekben 70-szer magasabb koncentrációban, mint az alfa-tokoferol esetében.[97][98]
Bőrhidratáló
szerkesztésTokotrienolok csökkentik a bőr vízveszteséget, és erősítik a bőr védő funkcióját. Önmagában vagy kombinációban más összetevőkkel javítják a bőr hidratáltságát, a bőr élettani funkcióit.[99]
Napfény elleni védelem
szerkesztésEllentétben a normál bőr öregedésével a napfény állandó és hosszan tartó káros UV sugár-expozíciója napfény okozta ráncosodást (fotó-aging) eredményez. Az UV-sugárzás növeli a szabad gyökök termelődését a bőrben, ahol a reaktív oxigénszármazékok a bőr különböző rétegeiben sejtkárosodást okozva siettetik az öregedési folyamatokat, és növelik a bőrrák kockázatát. Kiváló antioxidáns tulajdonsága 60-szor nagyobb, mint a tokoferolé és olyan képességgel rendelkeznek a tokotrienolok, amelyek segítenek megvédeni a bőrt a napozás UV okozta állandó és tartós károsodástól és a bőr öregedésétől.[100] A tokotrienol tartalmú készítmények bőr-szabad gyök tényezője (RSF) 4,15. Az RSF az anyagok azon képességét méri, hogy a bőr alatti UV expozíció okozta szabad gyökök képződésének mennyiségét mennyivel képesek csökkenteni. Az RSF 4,15 azt jelzi, hogy a Nap káros UV-A és UV-B sugár-expozícióval szemben a tokotrienol tartalmú készítmények 76%-kal csökkentik a szabad gyök képződését a bőrben.
Anti-Ageing
szerkesztésA bőr öregedés a normál öregedés része, és gyakran finom ráncokkal és a bőr lazaságával jár, miközben a nap által károsított bőr fokozott pigmentációval, elszíneződéssel és mély ráncokkal jár. A fibroblasztok olyan sejtek, amelyek megtalálhatók a bőrben, a csontokban és más szövetekben. Amikor nem avatkozunk be bőrvédelemmel, az oxidatív stressz hatására DNS-károsodás indukálódik ismételten, és ezekben a fibroblaszt sejtekben hozzájárul a celluláris öregedés hatásaihoz. A preklinikai vizsgálatok eredményei azt mutatták, hogy a tokotrienoloknak meg van az a képessége, hogy megakadályozzák az oxidatív stressz okozta celluláris öregedés hatásait az emberi diploid fibroblasztokban (HDF). Ezen túlmenően, a tokotrienolok növelték a hosszú DNS-struktúrákat, az úgynevezett telomereket. Telomerek fokozatosan egyre rövidülnek, valahányszor osztódnak. A legtöbb sejt telomer-hossza szoros kapcsolatban van a celluláris öregedéssel: minél rövidebb a telomer, annál idősebb a sejt.[101] Nagyon hatékonyan gátolják a tirozináz aktivitást (az enzim felelős a melanin-termelésért). Ez is segít megakadályozni a ráncok kialakulását a kollagén és elasztin bomlásának gátlása révén.[102]
Bőrregeneráló
szerkesztésA bőr regenerálása során a fibroblasztok a sérülésekhez vándorolnak és lezárják a sérülés nyílását. A tokotrienolok is képesek kiváltani a fibroblasztok vándorlását a seb felé, ami arra utal, hogy potenciális szerepük van a bőr regenerálásában és a sebgyógyulásban.[103]
Depigmentáció
szerkesztésGátolják a bőr pigmentációját a melanin-szintézis gátlása révén. A bőrvilágosító piac az előrejelzések szerint eléri a 10 000 000 000$-t 2015-re, a növekedésben legerősebb földrajzi terület az ázsiai-csendes-óceáni régióban várható.[104] Ahogy az megjelent a vezető Pigment Cell & Melanoma Research c. szaklapban a DavosLife kutatás kimutatta: a tokotrienoloknak megvan azon képessége, hogy elősegítik a bőr depigmentációját a kulcsfontosságú fehérje, a tirozináznak a melanin-szintézis gátlásán keresztül. Ebben a vizsgálatban a tokotrienolok csökkentették a melanin termelést 55%-kal, gátolták a tirozinázon keresztül, amely akár 150-szer hatásosabb, mint más bőr depigmentáló szer.[105]
Alopecia
szerkesztésA hipokoleszterinémiás, antitrombotikus, antioxidáns, antiaterogén, gyulladásgátló és immunszabályozó hatása mellett a tokotrienolok képesek a hajnövekedés elősegítésére vagy a hajhullás megelőzésére. Hatásukat valószínűleg annak köszönhetik, hogy az antioxidáns tokotrienolok csökkentik a lipidperoxidációt és az oxidatív stresszt a fejbőrben. A szájon át és helyileg alkalmazott tokotrienol tartalmú készítmények előnyösen felhalmozódnak a legfelső bőrrétegben, ennek köszönhetően megakadályozzák a bőr kollagénmátrixának öregedését és oxidációját. Klinikai tanulmányok bizonyítják hatékonyságát férfiak és nők androgén hormonok okozta kopaszságában. Az eredmények azt jelzik, hogy fokozzák az oxigén behatolását a kopasz, frontális fejbőrbe. A jó vérellátása a fejbőrnek elengedhetetlen a normális hajnövekedési ciklushoz.[106][107]
Angiogén eredetű szembetegségek vitaminja
szerkesztésA tokotrienolok alkalmazás javítja az angiogén jellegű szembetegségek állapotát. A központi látás elvesztése miatt előfordul makula degeneráció esetében (a rendellenes neovaszkularizációja a retinának) a retina alatt a makula szivárgó erei nyomják fel a retinát, amit megakadályoznak a tokotrienolok.[108] Diabéteszes retinopátiában, az inzulin okozta vakság megelőzésének gyógyszere lehet, a retina ereinek kemoprevencióján keresztül.[109] A glaucomaellenes filtratiós műtétek a szemnyomás csökkentését célozzák meg, mellyel elkerülhető a további progresszív nyomásdependens ganglionsejt pusztulás. A posztoperatív hegesedést a tokotrienolok csökkentik a Tenon-fibroblaszt okozta hegesedés esetében.[110] Antioxidánsként felhalmozódnak a szemben szürkehályog kialakulása során, amely a folyamat progresszióját csökkenti.[111]
Napi ajánlott adag
szerkesztésKlinikai vizsgálatok megállapították, hogy az optimális dózisa a tokotrienoloknak koleszterin-és triglicerid-csökkentésére 100 mg/nap.[112] A biztonságos adag különböző tokotrienolok emberi fogyasztásra szánt adagja esetén becslések szerint 200–1000 mg/nap.[113] Az étkezés növeli a tokotrienolok felszívódását a bélből.[114] Az esetleges interakció elkerülése céljából ajánlott a tokotrienolokat körülbelül hat óra eltéréssel bevenni a tokoferol tartalmú kiegészítők estén. Megjegyzendő, hogy a tokotrienolokat a Food and Drug Administration (FDA) gyógyszerként nem értékelte, tehát orvosi és gyógyszerészeti szempontból nem alkalmasak betegségek diagnosztizálására, kezelésére, gyógyítására vagy megelőzésére. Ha bármilyen diagnosztizált egészségügyi állapot befolyásolására tokotrienolokat alkalmazna, keresse fel az egyes egészségügyi szolgáltatókat, mielőtt bármilyen étrend-kiegészítőt választ.
Interakciók
szerkesztésGyógyszerekkel
szerkesztés- Antikoagulánsok és Trombocitaaggregációt gátlók
A tokotrienolok emelik a PT és az INR értékeket K-vitamin-hiányban szenvedő betegek esetében, és gátolják a vérlemezke-aggregációt.
- Antidiabetikumok
A humán kutatásokban, a magas tokotrienol adagok csökkentik a plazma-glükóz szintet.
- Antilipémiás anyagok
Az in vitro és klinikai bizonyítékok alapján csökkenthetik a koleszterinszintet.
- Daganatellenes szerek
Daganatellenes szerek: in vitro bizonyíték alapján, lovasztatin és d-gamma-tokotrienol kombinációjáról kimutatták, hogy blokkolják a sejt növekedését melanoma sejtekben, prosztata karcinóma sejtekben, és tüdő karcinóma sejtekben. Egy másik vizsgálatban, a keverék az alfa-, gamma-és delta-tokotrienolok gátolta a proliferációt az ösztrogénreceptor-negatív humán emlőrák sejtekben, szinergisra tamoxifennel együtt adva. Állatokra vonatkozó információk alapján, a lovasztatin kombinációja és a d-delta-tokotrienol csökkenését eredményezte tumortömegek egerekben.
- Citokróm P450
Citokróm P450 szubsztrátok, gátlók, induktorok alapján a másodlagos források, tokoferolok és tokotrienolok által metabolizált oldallánc degradáció kezdeményezett a citokróm P450 (CYP)-katalizált omega-hidroxilálás majd béta-oxidáció. Példák CYP4F2-metabolizált gyógyszerek és gyógynövények között K-vitamin, a warfarin és a sztatinok. Alapul véve génexpressziós analízis, delta-tokotrienol megnövekedett CYP1A1 gént, egy I. fázisú enzim.
- Immunmodulátor szerek
Az a képesség a tokotrienoloknak, hogy interakcióba lép a hízósejtekkel és ezáltal befolyásolja a proliferációját, a túlélését, degranulációt, és a migrációt.
- Neuroprotektív szerek
A kutatások azt igazolják, hogy az alfa-tokotrienol sokkal hatásosabb, mint az alfa-tokoferol in vitro HT4 védelmében és primer neuronális sejtek ellen a glutamát által kiváltott toxicitás valamint számos más toxinok. Nanomoláris koncentrációkban, tokotrienol, de nem tokoferol, teljesen védett idegsejtek egy antioxidáns-független mechanizmus.
- Sztatinok
In vitro bizonyítékkokkal prezentálható lovasztatin és d-gamma-tokotrienol kombinációjával, hogy blokkolják a sejt növekedését melanoma sejtekben, prosztata karcinómában, és tüdő karcinóma sejtjeiben
- Fogyasztó szerek
A kutatások alapján az alfa-és gamma-tokotrienol segíthet megelőzni éretlen zsírsejtek érett zsírsejtekké alakulását. Ez megakadályozza a tárolását a zsírnak, és segít megelőzni az elhízást.
Táplálékkiegészítőkkel
szerkesztés- Antioxidánsok
In vitro bizonyíték alapján, a tokotrienolok antioxidáns hatásokat fejtenek ki a humán glutation-S-transzferáz-1 P1 (GST P1-1) gátlásán keresztül, és reakcióba lépve a peroxil gyökökkel, amelyek a keringő humán lipoproteinekben helyezkednek el.[115]
- Citrus flavonoidok
Állatokra vonatkozó információk alapján, citrus flavonoidokkal együtt a tokotrienolok gátolhatják az emlődaganatok gyakoriságát.
Laboratóriumi értékek
szerkesztés- Glükóz
A humán kutatások alapján csökkentik a plazma-glükóz szintjét.
- Koleszterin
A tokotrienolok koleszterinszint-csökkentő hatása bizonyított.[116]
- C-reaktív protein
Csökkenti a C-reaktív fehérje értékét, ami a tokotrienolok kardioprotektív hatásával is magyarázható.[117]
- Citokinek
A proinflammatorikus citokinek értékei csökkentek lehetnek, amelyért részben felelős a kardioprotektív hatásai a tokotrienoloknak.[118]
- Protrombinidő, Nemzetközi Normalizált Ráta, PT / INR
A tokotrienolok növelik a PT és az INR értékeket K-vitamin-hiányban szenvedő betegeknél és gátolják a vérlemezke-aggregációt.[119]
Élelmiszerekkel
szerkesztés- Citrus flavonoidok: állatokra vonatkozó információk alapján a citrus flavonoidok a tokotrienolokkal együtt szedve gátolhatják az emlődaganatok gyakoriságát.
Struktúra és funkció
szerkesztésSzerkezeti különbségek és tulajdonságok
szerkesztésA 6-hidroxi-kromán molekularész és egy lipidekben oldható oldallánc (hosszabb fitil-csoport a tokoferolban vagy egy rövidebb farnezil-csoport tokotrienolban) alkotja a gyűjtőfogalomként ma ismert E-vitaminokat. Általában úgy gondolták, hogy csak négy féle tokoferol és négyféle tokotrienol létezik, vannak azonban, akik legalább 12-féle E-vitamint jegyeznek.
Jól ismert antioxidáns tulajdonságai a tokoferoloknak és tokotrienoloknak. Az alfa-tokotrienol 40-60-szor hatásosabb antioxidáns, mint az alfa-tokoferol.[120] Ez a védelem annak tulajdonítható, hogy a membránon keresztüli mobilitása hatékonyabb az alfa-tokotrienoloknak,[121][122] valószínűleg azért, mert rövidebb a farnezil oldallánca, amely kevésbé rögzül a membránokhoz.
További a mobilitást elősegítő szerkezeti különbség, hogy kisebb a fej mérete a tokotrienoloknak. Kémiailag a delta fej a legkisebb, a gamma- és béta közbenső fejek, és az alfa-fej a legnagyobb.[123] Alfa-tokoferol a legnagyobb méretű (legnagyobb molekulatömeg) és a delta-tokotrienol a legkisebb méretű (legkisebb molekulatömeg). A delta-tokotrienolt kisebb, mint 400 dalton.
A tokotrienolok szerkezeti izomerei
szerkesztésA természetes forrásokból kivont tokotrienolok a d-tokotrienolok. A tokotrienoloknak csak egyetlen királis központja van, amely a kromanol-gyűrű 2-es szénatomján helyezkedik el, azon a ponton, ahol az izoprenoid farok csatlakozik a gyűrűhöz, a másik két megfelelő királis központ a fitil-farkon lennének, de nem léteznek a tokotrienolok telítetlensége miatt.
Az α-tokotrienol 5,7,8-trimetil, β-tokotrienol 5,8-dimetil-, γ-tokotrienol 7,8-dimetil-tokotrienol és a δ-jelentése 8-monometil tokotrienol. A dezmetil tokotrienolok egy gyűjtőfogalom az E-vitamin izomerek között, a csökkentett metil-szubsztituensek számára utalva, elsődlegesen a delta-és gamma-tokotrienolra. A dezmetil tokotrienolok sokkal hatásosabbak, különösen, ha a kromanol gyűrűrendszer a C5-ös helyen elhelyezkedő metilcsoport hiányában. A delta-tokotrienol kromanol gyűrűrendszerének C8-as helyén monometilezett, így a legkevésbé helyettesített, és ezért így a leghatásosabb a négy izomer tokotrienol között.[124]
A koleszterin-szint csökkentésében, valamint a rák kezelésében képességük sorrendje a tokotrienol izomereknek a következő: delta> gamma> alfa> béta
| Név | Szerkezeti R-Izomerek | R1 | R2 |
|---|---|---|---|
| α-Tokotrienol [5,7,8-trimetil] (C29H44O2) | CH3 | CH3 | |
| β-Tokotrienol [5,8-dimetil] (C29H42O2) | CH3 | H | |
| γ-Tokotrienol [7,8-dimetil] (C28H42O2) | H | CH3 | |
| δ-Tokotrienol [8-monometil] (C27H40O2) | H | H |
Jegyzetek
szerkesztés- ↑ T ocotrienols: Vitamin E Beyond Tocopherols Szerkesztette: Barrie Tan, Ronald Ross Watson, Victor R. Preedy 2012.
- ↑ EGYETEMI DOKTORI (Ph. D.) ÉRTEKEZÉS Ischaemia-reperfusiós változások vizsgálata vékonybél segmenten és vékonybél transplantatiós állatkísérletes modelleken sebészeti- és mikrosebészeti technikák alkalmazásával Dr. Bráth Endre, Témavezető: Prof. Dr. Furka István az MTA doktora DEBRECENI EGYETEM KLINIKAI ORVOSTUDOMÁNYOK DOKTORI ISKOLA Debrecen, 2011.
- ↑ http://www.fda.gov/Food/GuidanceRegulation/GuidanceDocumentsRegulatoryInformation/LabelingNutrition/ucm063064.htm
- ↑ a b Biochemical Pharmacology 80 (2010) 1613–1631
- ↑ http://www.tocotrienol.org/
- ↑ Sen, C.K., Khanna, S., and Roy, S. Tocotrienols: Vitamin E beyond tocopherols. Life Sci. 78, 2088‐2098 (2006
- ↑ kromán: benzollal kondenzált dihidro-γ-pirán
- ↑ Ghosh, S.P., Hauer‐Jensen, M., and Kumar, K.S. Chemistry of tocotrienols. (2008).
- ↑ Phytochemistry, Volume 67, Issue 12, 2006, Pages 1185-1195 Horváth György, Ludger Wessjohann, Joseph Bigirimana, Marcel Jansen, Yves Guisez, Roland Caubergs, Nele Horemans
- ↑ BUDAPESTI MŰSZAKI ÉS GAZDASÁGTUDOMÁNYI EGYETEM Doktori értekezés: Új lehetőségek a kukorica termesztése és feldolgozása során keletkező melléktermékek hasznosítására, Szerző: Kálmán Gergely, Témavezető: Dr. Réczey Istvánné, Budapesti Műszaki és Gazdaságtudományi Egyetem Vegyészmérnöki és Biomérnöki Kar Alkalmazott Biotechnológia és Élelmiszertudományi Tanszék 2008.
- ↑ (Daguet, 2000)
- ↑ Klein, E.A., et al., Vitamin E and the risk of prostate cancer: the Selenium and Vitamin E Cancer Prevention Trial (SELECT). JAMA, 2011. 306(14): p. 1549-56.
- ↑ Dunphy PJ, Whittle KJ, Pennock JF, Morton RA. Identification and estimation of tocotrienols in Hevea latex. Nature 1965;201:521–2.
- ↑ Dunphy, PJ, Whittle, KJ, Pennock, JF, Morton, RA (1965). "Azonosítása és becslése tokotrienolok a Hevea Latex". Nature 207 (4996): 521. DOI: 10.1038/207521a0
- ↑ Pennock, J.F., F.W. Hemming, and J.D. Kerr, A reassessment of tocopherol in chemistry. Biochem Biophys Res Commun, 1964. 17(5): p. 542-8
- ↑ Pearce BC, Parker RA, Deason ME, Qureshi AA, Wright JJ (1992 októbere). "Hipokoleszterolémiás aktivitás szintetikus és természetes tokotrienolok". J. Med. Chem. 35 (20): 3595-606. DOI: 10.1021/jm00098a002 . PMID 1433170
- ↑ Watson, Ronald R., Preedy, Victor R., szerk. (2008). tokotrienolok: E-vitamin túl tokoferolok . Sánc: CRC Press. ISBN 978-1-4200-8037-7 .
- ↑ Sundram K, Khor HT, Ong AS, Pathmanathan R. Effect of dietary palm oils on mammary carcinogenesis in female rats induced by 7,12-dimethylbenz(a)anthracene. Cancer Res 1989;49:1447–51.
- ↑ Szerkesztők: Barrie Tan az elnöke American River Nutrition, Inc. Hadley, Massachusetts, USA. Ronald Ross Watson professzor, a College of Public Health és School of Medicine, a University of Arizona, Tucson, USA. Victor R. Preedy az igazgatója Genomikai Központ a King 's College London, Egyesült Királyság. ISBN 9781439884416 Kiadó: Taylor & Francis A megjelenés dátuma: 2012/09/13
- ↑ http://jxb.oxfordjournals.org/content/61/6/1549/T1.expansion.html#xref-fn-1-1
- ↑ http://www.cancercontrolsociety.com/bio2011/an.html[halott link]
- ↑ ^ Smith, James (2006). "Annatto Extracts" (PDF). Chemical and Technical Assessment. JECFA. Hozzáférés ideje: 03 Feb 2012.
- ↑ Bramley és mtsai., 2000; Foyer és mtsai., 1994; Smirnoff, 1993
- ↑ Chrost et al., 1999, Munne-Bosch és Alegre, 2002.
- ↑ Franzen és Haab, 1991
- ↑ http://www.szote.u-szeged.hu/mdbio/hun/hunold/anyagok/2009-2010/I.%20felev/hatar/3.%20ea%20Szignal/Szignal%20transzdukcio%20HU%20(vegso).pdf[halott link]
- ↑ Tocochromanol functions in plants: antioxidation and beyond Journal of Experimental Botany, Vol. 61, No. 6, pp. 1549–1566, 2010
- ↑ (Bisby és Ahmed, 1989; Kagan és a Quinn 1988
- ↑ Validation Of QTL Associated With Tocopherol Levels In Three Half-Sib Populations Derived From Keszthelyi Aproszemu Sarga Soybean by Mark MacDuff A Thesis presented to The University of Guelph In partial fulfilment of requirements for the degree of Master of Science in Plant Agriculture Guelph, Ontario, Canada © Mark MacDuff, December, 2011
- ↑ Schultz és mtsai., 1991; Dormann, 2003
- ↑ The impact of tocochromanols on germination and NO release S2-4 Christine Desel Institute of Botany, Christian-Albrechts-University of Kiel, Germany cdesel@bot.uni-kiel.de
- ↑ Pearson, C.K. and M.M. Barnes, The absorption and distribution of the naturally occurring tocochromanols in he rat. Br J Nutr, 1970. 24(2): p. 581-7.
- ↑ Palozza, P., et al., Comparative antioxidant activity of tocotrienols and the novel chromanylpolyisoprenyl molecule FeAox-6 in isolated membranes and intact cells. Mol Cell Biochem, 2006. 287(1-2): p. 21-32.
- ↑ Tan, B., Appropriate spectrum vitamin E and new perspectives on desmethyl tocopherols and tocotrienols. JANA, 2005. 8(1): p. 35-42.
- ↑ Qureshi, A.A. and H. Mo, Isolation and structural identification of novel tocotrienols from rice bran with hypocholesterolemic, antioxidant and antitumor properties. J Agric Food Chem, 2000(131): p. 223-230
- ↑ Wang és Quinn, 2000.
- ↑ Muller, L., K. Theile, and V. Bohm, In vitro antioxidant activity of tocopherols and tocotrienols and comparison of vitamin E concentration and lipophilic antioxidant capacity in human plasma. Mol Nutr Food Res, 2010. 54(5): p. 731-42.
- ↑ Abid et al., 2005; Cachofeiro et al., 2008; Koyner et al., 2008).
- ↑ J Pharmacol Exp Ther. 2012 February; 340(2): 330–338. doi: 10.1124/jpet.111.186882 PMCID: PMC326395 γ-Tocotrienol Protects against Mitochondrial Dysfunction and Renal Cell Death Grażyna Nowak, Diana Bakajsova, Corey Hayes, Martin Hauer-Jensen, and Cesar M. Compadre
- ↑ Pearce, B.C., et al., Hypocholesterolemic activity of synthetic and natural tocotrienols. J Med Chem, 1992. 35(20): p. 3595-606
- ↑ Qureshi, A.A., et al., Dietary alpha-tocopherol attenuates the impact of gamma-tocotrienol on hepatic 3-hydroxy-3-methylglutaryl coenzyme A reductase activity in chickens. J Nutr, 1996. 126(2): p. 389-94
- ↑ Mensink, R.P., et al., A vitamin E concentrate rich in tocotrienols had no effect on serum lipids, lipoproteins, or platelet function in men with mildly elevated serum lipid concentrations. Am J Clin Nutr, 1999. 69(2): p. 213-9.
- ↑ Mustad, V.A., et al., Supplementation with 3 compositionally different tocotrienol supplements does not improve cardiovascular disease risk factors in men and women with hypercholesterolemia. Am J Clin Nutr, 2002. 76(6): p. 1237-43.
- ↑ Ikeda, S., et al., Dietary alpha-tocopherol decreases alpha-tocotrienol but not gamma-tocotrienol concentration in rats. J Nutr, 2003. 133(2): p. 428-34. 20. Khanna, S., et al., Delivery of orally supplemented alpha-tocotrienol to vital organs of rats and tocopherol-transport protein deficient mice. Free Radic Biol Med, 2005. 39(10): p. 1310-9. 21. Uchida, T., et al., Tissue Distribution of alpha- and gamma-Tocotrienol and gamma-Tocopherol in Rats and Interference with Their Accumulation by alpha-Tocopherol. Lipids, 2011.
- ↑ Qureshi, A.A., et al., Dietary alpha-tocopherol attenuates the impact of gamma-tocotrienol on hepatic 3-hydroxy-3-methylglutaryl coenzyme A reductase activity in chickens. J Nutr, 1996. 126(2): p. 389-94.
- ↑ Shibata, A., et al., alpha-Tocopherol attenuates the cytotoxic effect of delta-tocotrienol in human colorectal adenocarcinoma cells. Biochem Biophys Res Commun, 2010.
- ↑ a b Sontag, T.J. and R.S. Parker, Influence of major structural features of tocopherols and tocotrienols on their omega-oxidation by tocopherol-omega-hydroxylase. J Lipid Res, 2007. 48(5): p. 1090-8.
- ↑ Brigelius-Flohe, R., Adverse effects of vitamin E by induction of drug metabolism. Genes Nutr, 2007. 2(3): p. 249-56.
- ↑ Khor, H.T., D.Y. Chieng, and K.K. Ong, Tocotrienols: A Dose-Dependent Inhibitor for HMGCoA Reductase, in Nutrition, Lipids, Health, and Disease, A.S.H. Ong, E. Niki, and L. Packer, Editors. 1995, AOCS Press: Champaign, Illinois. p. 104-108. 26. Khor, H.T., D.Y. Chirng, and K.K. Ong, Tocotrienols inhibit HMG-CoA reductase activity in the guinea pig. Nutr. Res., 1995(15): p. 537-544. 27. Khor, H.T. and T.T. Ng, Effects of administration of alpha-tocopherol and tocotrienols on serum lipids and liver HMG CoA reductase activity. Int J Food Sci Nutr, 2000. 51 Suppl: p. S3-11. 28. Miyamoto, K., et al., Very-high-dose alpha-tocopherol supplementation increases blood pressure and causes possible adverse central nervous system effects in stroke-prone spontaneously hypertensive rats. J Neurosci Res, 2009. 87(2): p. 556-66
- ↑ Campbell, S.E., et al., gamma-Tocotrienol induces growth arrest through a novel pathway with TGFbeta2 in prostate cancer. Free Radic Biol Med, 2011. 50(10): p. 1344-54
- ↑ New York. p. 247-267. 38. Chao, J.T., A. Gapor, and A. Theriault, Inhibitory effect of delta-tocotrienol, a HMG CoA reductase inhibitor, on monocyte-endothelial cell adhesion. J Nutr Sci Vitaminol (Tokyo), 2002. 48(5): p. 332-7. 39. Theriault, A., J.T. Chao, and A. Gapor, Tocotrienol is the most effective vitamin E for reducing endothelial expression of adhesion molecules and adhesion to monocytes. Atherosclerosis, 2002. 160(1): p. 21-30.
- ↑ a b Naito, Y., et al., Tocotrienols reduce 25-hydroxycholesterol-induced monocyte-endothelial cell interaction by inhibiting the surface expression of adhesion molecules. Atherosclerosis, 2005. 180(1): p. 19-25.
- ↑ Passwater, R.A., Health Benefits Beyond Vitamin E Activity:Solving the Tocotrienol Riddle An Interview with Dr. Barrie Tan. Whole Foods Magazine, 2008(June/July 2008).
- ↑ Centers for Disease Control and Prevention, America's Cholesterol Burden. 2011.
- ↑ 199-207. 18. Tan, B. and A.M. Mueller, Tocotrienols in Cardiometabolic Diseases., in Tocotrienols: Vitamin E beyond Tocopherol, R. Watson and V. Preedy, Editors. 2008, AOCS/CRC Press. p. 257-273.
- ↑ Chao, J.T., A. Gapor, and A. Theriault, Inhibitory effect of delta-tocotrienol, a HMG CoA reductase inhibitor, on monocyte-endothelial cell adhesion. J Nutr Sci Vitaminol (Tokyo), 2002. 48(5): p. 332-7.
- ↑ Newaz, M.A. and N.N. Nawal, Effect of gamma-tocotrienol on blood pressure, lipid peroxidation and total antioxidant status in spontaneously hypertensive rats (SHR). Clin Exp Hypertens, 1999. 21(8): p. 1297-313.
- ↑ Newaz, M.A., et al., Nitric oxide synthase activity in blood vessels of spontaneously hypertensive rats: antioxidant protection by gamma-tocotrienol. J Physiol Pharmacol, 2003. 54(3): p. 319-27.
- ↑ Rasool, A.H., et al., Arterial compliance and vitamin E blood levels with a self emulsifying preparation of tocotrienol rich vitamin E. Arch Pharm Res, 2008. 31(9): p. 1212-7. 46. Rasool, A.H., et al., Dose dependent elevation of plasma tocotrienol levels and its effect on arterial compliance, plasma total antioxidant status, and lipid profile in healthy humans supplemented with tocotrienol rich vitamin E. J Nutr Sci Vitaminol (Tokyo), 2006. 52(6): p. 473-8.
- ↑ Tomeo, A.C., et al., Antioxidant effects of tocotrienols in patients with hyperlipidemia and carotid stenosis. Lipids, 1995. 30(12): p. 1179-83. Watkins, T.R., et al., Hypocholesterolemic and antioxidant effect of rice bran oil non-saponifiables in hypercholesterolemic subjects. Env & Nutr Int, 1999. 3: p. 115-122. Kooyenga, D.K., et al., Antioxidants modulate the course of carotid atherosclerosis: A four-year report., in Micronutrients and Health, K. Nesaretnam and L. Packer, Editors. 2001, AOCS Press: Illinois. p. 366-375.
- ↑ DR. TERUO MIYAZAWA ANTI-ANGIOGENIC EFFECTS OF TOCOTRIENOL INTERNATIONAL TOCOTRIENOL SYMPOSIUM APRIL 29, 2012 ◦ LONG BEACH, CALIFORNIA
- ↑ Tocotrienol Suppresses Adipocyte Differentiation and Akt Phosphorylation in 3T3-L1 Preadipocytes1–3[halott link] Harumi Uto-Kondo, 4 Reiko Ohmori, 5 Chikako Kiyose, 6 Yoshimi Kishimoto, 7 Hisako Saito, 8 Osamu Igarashi, 9 and Kazuo Kondo7 *
- ↑ J Atheroscler Thromb. 2010 Oct 27;17(10):1019-32. Epub 2010 Aug 10. Gamma delta tocotrienols reduce hepatic triglyceride synthesis and VLDL secretion. Zaiden N, Yap WN, Ong S, Xu CH, Teo VH, Chang CP, Zhang XW, Nesaretnam K, Shiba S, Yap YL.
- ↑ Tan, B. and A.M. Mueller, Tocotrienols in Cardiometabolic Diseases., in Tocotrienols: Vitamin E beyond Tocopherol, R. Watson and V. Preedy, Editors. 2008, AOCS/CRC Press. p. 257-273. Qureshi, A.A., S.A. Sami, and F.A. Khan, Effects of stabilized rice bran, its soluble and fiber fractions on blood glucose levels and serum lipid parameters in humans with diabetes mellitus Types I and II. J Nutr Biochem, 2002. 13(3): p. 175-187. 63. Montonen, J., et al., Dietary antioxidant intake and risk of type 2 diabetes. Diabetes Care, 2004. 27(2): p. 362-6. 64. Baliarsingh, S., Z.H. Beg, and J. Ahmad, The therapeutic impacts of tocotrienols in type 2 diabetic patients with hyperlipidemia. Atherosclerosis, 2005. 182(2): p. 367-74.
- ↑ MEVALONATE-SUPPRESSIVE TOCOTRIENOLS FOR CANCER CHEMOPREVENTION AND ADJUVANT THERAPY DR. HUANBIAO MO INTERNATIONAL TOCOTRIENOL SYMPOSIUM SECOND APRIL 29, 2012 ◦ LONG BEACH, CALIFORNIA
- ↑ Theriault, A., et al, tocotrienol:. Revision of the therapeutic options. Clin Biochem 1999th 32 (5): p. 309-19.
- ↑ a b .. Elson, CE, suppression of the mevalonate path activities dietary isoprenoids: protective roles in cancer and cardiovascular disease. J Nutr, 1995th 125 (6 Suppl): p. 1666S-1672S
- ↑ 68th. Miyazawa, T., Anti-angiogenic function et al. Tocotrienol. Asia Pac J Clin Nutr, of 2008. 17 Suppl 1 p. 253-6. 69th. Nakagawa, K. and DNA chip analysis of comprehensive food function, et al: Inhibition. Angiogenesis and telomerase activity unsaturated vitamin E, tocotrienol. Biofactors, 2004th 21 (1-4): p. 5-10. Biochem Pharmacol. 2008 Aug 1;76(3):330-9. doi: 10.1016/j.bcp.2008.05.017. Epub 2008 May 28. Tumor anti-angiogenic effect and mechanism of action of delta-tocotrienol. Shibata A, Nakagawa K, Sookwong P, Tsuzuki T, Oikawa S, Miyazawa T. Source Food and Biodynamic Chemistry Laboratory, Graduate School of Agricultural Science, Tohoku University, Sendai 981-8555, Japan.
- ↑ American Cancer Society. Cancer Facts & Figures. 2011 [cited; Available from: www.cancer.org/acs/groups/content/@epidemiologysurveilance/documents/doc... (http://www.cancer.org/acs/groups/content/@epidemiology[halott link] surv eilance/documents/document/acspc-029771.pdf)
- ↑ Springett, G., et al., A phase I dose-escalation study of the safety, PK, and PD of vitamin E delta-tocotrienol administered to subjects with resectable exocrine neoplasia., in 102nd Annual Meeting of the American Association for Cancer Research. 2011: Orlando, FL.
- ↑ Husain, K., et al., Vitamin E delta-tocotrienol levels in tumor and pancreatic tissue of mice after oral administration. Pharmacology, 2009. 83(3): p. 157-63. Husain, K., et al., Vitamin E delta-tocotrienol augments the antitumor activity of gemcitabine and suppresses constitutive NF-kappaB activation in pancreatic cancer. Mol Cancer Ther, 2011. 10(12): p. 2363-72. Hussein, D. and H. Mo, d-Delta-tocotrienol-mediated suppression of the proliferation of human PANC-1, MIA PaCa-2, and BxPC-3 pancreatic carcinoma cells. Pancreas, 2009. 38(4): p. e124-36. Shin-Kang, S., et al., Tocotrienols inhibit AKT and ERK activation and suppress pancreatic cancer cell proliferation by suppressing the ErbB2 pathway. Free Radic Biol Med, 2011. 51(6): p. 1164-74.
- ↑ Nesaretnam, K., et al., Effect of tocotrienols on the growth of a human breast cancer cell line in culture. Lipids, 1995. 30(12): p. 1139-43.
- ↑ Nesaretnam, K., et al., Tocotrienols inhibit the growth of human breast cancer cells irrespective of estrogen receptor status. Lipids, 1998. 33(5): p. 461-9.
- ↑ Campbell, S.E., et al., gamma-Tocotrienol induces growth arrest through a novel pathway with TGFbeta2 in prostate cancer. Free Radic Biol Med, 2011. 50(10): p. 1344-54. Constantinou, C., et al., Induction of caspase-independent programmed cell death by vitamin E natural homologs and synthetic derivatives. Nutr Cancer, 2009. 61(6): p. 864-74.
- ↑ Traber, M.G., et al., Penetration and distribution of alpha-tocopherol, alpha- or gamma- tocotrienols applied individually onto murine skin. Lipids, 1998. 33(1): p. 87-91. Packer, L., S.U. Weber, and G. Rimbach, Molecular aspects of alpha-tocotrienol antioxidant action and cell signalling. J Nutr, 2001. 131(2): p. 369S-73S. Qureshi, A.A., et al., Tocotrienols inhibit lipopolysaccharide-induced pro-inflammatory cytokines in macrophages of female mice. Lipids Health Dis, 2011. 9(1): p. 143. Qureshi, A.A., et al., delta-Tocotrienol and quercetin reduce serum levels of nitric oxide and lipid parameters in female chickens. Lipids Health Dis, 2011. 10: p. 39. Yam, M.L., et al., Tocotrienols suppress proinflammatory markers and cyclooxygenase-2 expression in RAW264.7 macrophages. Lipids, 2009. 44(9): p. 787-97. Yap, W.N., et al., Gamma- and delta-tocotrienols inhibit cutaneous melanosis (hallmark of melanoma) by suppressing constitutive and UV-induced tyrosinase activation., in 102nd Annual Meeting of the American Association for Cancer Research. 2011: Orlando, FL. He, L., et al., Isoprenoids suppress the growth of murine B16 melanomas in vitro and in vivo. J Nutr, 1997. 127(5): p. 668-74. McAnally, J.A., et al., Tocotrienols potentiate lovastatin-mediated growth suppression in vitro and in vivo. Exp Biol Med (Maywood), 2007. 232(4): p. 523-31. Mizushina, Y., et al., Inhibitory effect of tocotrienol on eukaryotic DNA polymerase lambda and
- ↑ Wada, S., et al., Tumor suppressive effects of tocotrienol in vivo and in vitro. Cancer Lett, 2005. 229(2): p. 181-91.
- ↑ i, X., et al., Inhibition of cell growth and induction of apoptosis in non-small cell lung cancer cells by delta-tocotrienol is associated with Notch-1 down-regulation. J Cell Biochem, 2011. Yano, Y., et al., Induction of cytotoxicity in human lung adenocarcinoma cells by 6-O-carboxypropyl-alpha-tocotrienol, a redox-silent derivative of alpha-tocotrienol. Int J Cancer, 2005. 115(5): p. 839-46. Wada, S., et al., Tumor suppressive effects of tocotrienol in vivo and in vitro. Cancer Lett, 2005. 229(2): p. 181-91.
- ↑ Zhang, J.S., et al., A paraptosis-like cell death induced by delta-tocotrienol in human colon carcinoma SW620 cells is associated with the suppression of the Wnt signaling pathway. Toxicology, 2011. 285(1-2): p. 8-17. Sun, W., et al., Gamma-tocotrienol-induced apoptosis in human gastric cancer SGC-7901 cells is associated with a suppression in mitogen-activated protein kinase signalling. Br J Nutr, 2008. 99(6): p. 1247-54. Xu, W.L., et al., Inhibition of proliferation and induction of apoptosis by gamma-tocotrienol in human colon carcinoma HT-29 cells. Nutrition, 2009. 25(5): p. 555-66. Gillen, C.D., et al., Ulcerative colitis and Crohn's disease: a comparison of the colorectal cancer risk in extensive colitis. Gut, 1994. 35(11): p. 1590-2. Luna, J., et al., Tocotrienols have potent antifibrogenic effects in human intestinal fibroblasts. Inflamm Bowel Dis, 2011. 17(3): p. 732-41.
- ↑ The comparative effects between tocotrieonol-rich fraction (TRF) and α- tocopherol on glutamate toxicity in neuron-astrocyte mono- and co- culture systems Yap Hui Min, Huzwah Khaza’ai, Mohd Sokhini Abdul Mutalib and Ibrahim Musa International Journal of Biomedical And Advance Research IJBAR (2013)04(06)
- ↑ VITAMIN E FAMILY AND ALZHEIMER’S DISEASE DR. FRANCESCA MANGIALASCHE INTERNATIONAL TOCOTRIENOL SYMPOSIUM SECOND HOSTED BY AMERICAN RIVER NUTRITION, INC. APRIL 29, 2012 ◦ LONG BEACH, CALIFORNIA
- ↑ Biosci Biotechnol Biochem. február 2002, 66 (2) :398-403. Begum AN , Terao J .
- ↑ ROLE OF TOCOTRIENOLS IN INFLAMMATORY DISEASES Bharat B. Aggarwal, Ph.D. Cytokine Research Laboratory, Department of Experimental Therapeutics, The University of Texas M. D. Anderson Cancer Center, Houston, Texas 77030, U.S.A. DR. BHARAT AGGARWAL GANIZING COMMITTEE: BARRIE TAN ◦ ANNE TRIAS ◦ HUANBIAO MO NDAY 8:30AM-5:30PM ◦ APRIL 29, 2012 ◦ LONG BEACH, CALIFORNIA INTERNATIONAL TOCOTRIENOL SYMPOSIUM SECOND HOSTED BY AMERICAN RIVER NUTRITION, INC. IN CONJUNCTION WITH 103RD AOCS ANNUAL MEETING
- ↑ Qureshi, AA, et al., Tokotrienolok makrofágokban gátolják a lipopoliszacharid-indukált pro-inflammatorikus citokineket. Lipid Health Dis, 2011. 9 (1): p. 143.
- ↑ A, Qureshi, et al ., “Delta-Tocotrienol and Quercetin Reduce Serum Levels of Nitric Oxide and Lipid Parameters in Female Chickens,” Lipids Health Dis ., 10, 39 (2011). 13.
- ↑ K. Nesaretnam and P. Meganathan, “Tocotrienols: Inflammation and Cancer,” Ann. NY Acad. Sci. 1229 (1), 18–22 (2011). 14. M.L., Yam, et al., “Tocotrienols Suppress Proinflammatory Markers and Cyclooxygenase-2 Expression in RAW264.7 Macrophages,” Lipids, 44 (9), 787–797 (2009).
- ↑ PURE TOCOTRIENOL ISOMERS BUT NOT TOCOPHEROL INHIBIT INFLAMMATION, ENDOTHELIAL ACTIVATION AND MONOCYTE BINDING ACTIVITY IN STIMULATED ENDOTHELIAL CELLS Muid S1 , Froemming GRA2 , Nawawi H1 1 Faculty of Medicine, Universiti Teknologi MARA, Sungai Buloh, Selangor, Malaysia, 2 Institute for Medical Molecular Biotechnology, Faculty of Medicine, Universiti Teknologi MARA, Sungai Buloh, Selangor, Malaysia DR. HAPIZAH NAWAWI APRIL 29, 2012 ◦ LONG BEACH, CALIFORNIA INTERNATIONAL TOCOTRIENOL SYMPOSIUM SECOND HOSTED BY AMERICAN RIVER NUTRITION, INC. IN CONJUNCTION WITH 103RD AOCS ANNUAL MEETING
- ↑ Am. J. Clin Nutr. 1991 április, 53 (4 Suppl): 1042S-1046S. Qureshi AA , N Qureshi , Hasler Rapacz-JO , Weber FE , Chaudhary V , TD Crenshaw , Gapor A , AS Ong , Chong YH , Peterson D. , et al.
- ↑ Naito: Gastroenterology 2005. 180(1) p19-25.
- ↑ Kulkarni, Shilpa, Ghosh, Sanchita P.; Satyamitra, Merriline; Mog, Steven; Hieber, Kevin; Romanyukha, Lyudmila; Gambles, Kristen; Toles, Raymond; Kao, Tzu-Cheg; Hauer-Jensen, Martin; Kumar, K. Sree (2010. március 1.). „Gamma-Tocotrienol Protects Hematopoietic Stem and Progenitor Cells in Mice after Total-Body Irradiation”. Radiation Research 173 (6), 738–747. o. DOI:https://doi.org/10.1667/RR1824.1.
- ↑ Li, Xiang Hong, Fu, Dadin; Latif, Nabil H.; Mullaney, Conor P.; Ney, Patrick H.; Mog, Steven R.; Whitnall, Mark H.; Srinivasan, Venkataraman; Xiao, Mang (2010. december 1.). „δ-tocotrienol protects mouse and human hematopoietic progenitors from γ-irradiation through extracellular signal-regulated kinase/mammalian target of rapamycin signaling”. Haematologica 95 (12), 1996–2004. o. DOI:https://dx.doi.org/10.3324%2Fhaematol.2010.026492.
- ↑ Ghosh, Sanchita P., Kulkarni, Shilpa; Hieber, Kevin; Toles, Raymond; Romanyukha, Lyudmila; Kao, Tzu-Cheg; Hauer-Jensen, Martin; kumar, K. Sree (2009. január 1.). „Gamma-tocotrienol, a tocol antioxidant as a potent radioprotector”. International Journal of Radiation Biology 85 (7), 598–606. o. DOI:10.1080/09553000902985128.
- ↑ Satyamitra, Merriline M., Kulkarni, Shilpa; Ghosh, Sanchita P.; Mullaney, Conor P.; Condliffe, Donald; Srinivasan, Venkataraman (2011. június 1.). „Hematopoietic Recovery and Amelioration of Radiation-Induced Lethality by the Vitamin E Isoform δ-Tocotrienol”. Radiation Research 175 (6), 736–745. o. DOI:10.1667/RR2460.1.
- ↑ Makpol, Suzana, Abidin, Azrina Zainal; Sairin, Khalilah; Mazlan, Musalmah; Top, Gapor Md; Ngah, Wan Zurinah Wan (2010. január 2.). „γ-Tocotrienol Prevents Oxidative Stress-Induced Telomere Shortening in Human Fibroblasts Derived from Different Aged Individuals”. Oxidative Medicine and Cellular Longevity 3 (1), 35–43. o. DOI:10.4161/oxim.3.1.9940.
- ↑ Chin, Siok-Fong, Hamid, Noor Aini Abdul; Latiff, Azian Abdul; Zakaria, Zaiton; Mazlan, Musalmah; Yusof, Yasmin Anum Mohd; Karim, Aminuddin Abdul; Ibahim, Johari; Hamid, Zalina; Ngah, Wan Zurinah Wan (2008. január 1.). „Reduction of DNA damage in older healthy adults by Tri E® Tocotrienol supplementation”. Nutrition 24 (1), 1–10. o. DOI:10.1016/j.nut.2007.08.006.
- ↑ Serbinova E, et al. Free Radic Biol Med, 1991. 10(5): p. 263-75
- ↑ Khan MS, et al. Eur Rev Med Pharmacol Sci., 2011.15(8): p. 916-30
- ↑ Saito Y, et al. Ann N Y Acad Sci, 2004. 1031: p. 368-75.
- ↑ Podda M, et al. J Lipid Res, 1996. 37(4): p. 893-901.
- ↑ DavosLife: Data on File.2013.
- ↑ 1. Saito Y, et al. Ann N Y Acad Sci, 2004. 1031: p. 368-75
- ↑ Chin SF, et al. Nutrition, 2008. 24(1): p. 1-10.
- ↑ Archivált másolat. [2013. július 18-i dátummal az eredetiből archiválva]. (Hozzáférés: 2013. július 19.)
- ↑ DavosLife: Data on File.
- ↑ Armstrong L. Global skin lighteners market booms. 2009 [cited 2012 January 16]; www.cosmeticdesign.com.
- ↑ Yap WN, et al. Pigment Cell Melanoma Res. 23(5): p. 688-92.
- ↑ HO D. et al. Hair growth formulation; US patent 7211274
- ↑ Tropical Life Sciences Research, 21(2), 91–99, 2010 Effects of Tocotrienol Supplementation on Hair Growth in Human Volunteers 1 Lim Ai Beoy, 2 Wong Jia Woei and 1 Yuen Kah Hay * 1 School of Pharmaceutical Sciences, Universiti Sains Malaysia, 11800 USM
- ↑ Miyazawa, T., et al., Antiangiogenic and anticancer potential of unsaturated vitamin E (tocotrienol). J Nutr Biochem, 2009. 20(2): p. 79-86. 110. Shibata, A., et al., delta-Tocotrienol suppresses VEGF induced angiogenesis whereas alpha- tocopherol does not. J Agric Food Chem, 2009. 57(18): p. 8696-704.
- ↑ TERUO MIYAZAWA, PhD Tohoku U/Sendai/JAPAN Anti-Angiogenic Effects of Tocotrienols INTERNATIONAL TOCOTRIENOL SYMPOSIUM HOSTED BY AMERICAN RIVER NUTRITION, INC.IN CONJUNCTION WITH 103RD AOCS ANNUAL MEETING APRIL 29, 2012 ◦ LONG BEACH, CALIFORNIA
- ↑ Glaucoma Research Foundation. Glaucoma Facts and Stats. 2011 [cited 2011 December 5]; Available from: http://www.glaucoma.org/glaucoma/facts-statistics/glaucoma-facts-and-stats.php Archiválva 2013. július 26-i dátummal a Wayback Machine-ben. Tappeiner, C., et al., Antifibrotic effects of tocotrienols on human Tenon's fibroblasts. Graefes Arch Clin Exp Ophthalmol, 2009.
- ↑ Tanito, M., et al., Distribution of tocopherols and tocotrienols to rat ocular tissues after topical ophthalmic administration. Lipids, 2004. 39(5): p. 469-74.
- ↑ Qureshi, A.A., et al., Dose-dependent suppression of serum cholesterol by tocotrienol-rich fraction (TRF25) of rice bran in hypercholesterolemic humans. Atherosclerosis, 2002. 161(1): p. 199-207.
- ↑ Yu, S.G., et al., Dose-response impact of various tocotrienols on serum lipid parameters in 5- week-old female chickens. Lipids, 2006. 41(5): p. 453-61
- ↑ tocochromanols in he rat. Br J Nutr, 1970. 24(2): p. 581-7. 31. Yap, S.P., K.H. Yuen, and J.W. Wong, Pharmacokinetics and bioavailability of alpha-, gammaand delta-tocotrienols under different food status. J Pharm Pharmacol, 2001. 53(1): p. 67-71.
- ↑ Biochim Biophys Acta. 1993 Feb 24;1166(2-3):163-70. Comparative antioxidant activity of tocotrienols and other natural lipid-soluble antioxidants in a homogeneous system, and in rat and human lipoproteins. Suarna C, Hood RL, Dean RT, Stocker R.
- ↑ J Biol Chem. 1993 May 25;268(15):11230-8. Tocotrienols regulate cholesterol production in mammalian cells by post-transcriptional suppression of 3-hydroxy-3-methylglutaryl-coenzyme A reductase.
- ↑ Vitam Horm. 2007;76:419-33. Tocotrienols in cardioprotection. Das S, Nesaretnam K, Das DK. Source Cardiovascular Research Center, University of Connecticut School of Medicine, Farmington, Connecticut 06030, USA.
- ↑ V itam Horm. 2007;76:519-49. Vitamin E: inflammation and atherosclerosis. Singh U, Devaraj S. Source Department of Pathology Laboratory for Atherosclerosis and Metabolic Research UC Davis Medical Center, Sacramento, California 95817, USA.
- ↑ Am J Clin Nutr. 1981 Sep;34(9):1701-5. Effect of vitamin E on prothrombin levels in warfarin-induced vitamin K deficiency. Corrigan JJ Jr, Ulfers LL.
- ↑ Serbinova E, et al. Free radical recycling and intramembrane mobility in the antioxidant properties of alpha-tocopherol and alpha-tocotrienol. Free Rad Biol Med. 1991;10:263-275
- ↑ Yoshida Y, et al. Comparative study on the action of tocopherols and tocotrienols as antioxidant: Chemical and physical effects. Chem Phys Lip. 2003;123:63-75.
- ↑ Packer L, et al. Molecular aspects of alpha-tocotrienol antioxidant action and cell signaling. J Nutr. 2001;131:(suppl) 369S-373S.
- ↑ Atkinson, J., R.F. Epand, and R.M. Epand, Tocopherols and tocotrienols in membranes: a critical review. Free Radic Biol Med, 2008. 44(5): p. 739-64.
- ↑ Vitamin E: Tocotrienols The Science Behind Tocotrienols Barrie Tan, PhD
Források
szerkesztés- The Next Generation Vitamin E Focus Allergy Research Group® Newsletter April 2013
- The EFSA Journal (2008) 640, 1-34 © European Food Safety Authority, 2008 Opinion on mixed tocopherols, tocotrienol tocopherol and tocotrienols as sources for vitamin E added as a nutritional substance in food supplements
- http://www.kyaniscience.com/assets/docs/whitepapers/Tocotrienols_Science_White_Paper-1.12-EN-ALL.pdf
- Gupta VK, Sharma SK. Plants as natural antioxidants. Natural Product Radiance 2006; 5(4): 326-334.
- Prakash A, Rigelhof F, Miller E. Antioxidant activity. http://www.medlabs.com/Downloads/Antiox_acti_.pdf
- Quideau SP, et al. Plant polyphenols: chemical properties, biological activities, and synthesis. Angewandte Chemie International Edition 2011; 50(3): 586.
- Halliwell B. Free radicals and antioxidants: updating a personal view. Nutr Rev 2012; 70(5): 257-65.
- Barrie Tan Ronald Ross Watson: Tocotrienols: Vitamin E Beyond Tocopherols ISBN 9781439884416 Taylor & Francis 2012
- Biogenesis, molecular regulation and function of plant isoprenoids Florence Bouvier, Alain Rahier, Bilal Camara Progress in Lipid Research 44 (2005) 357–429
- Tocochromanol functions in plants: antioxidation and beyond Jon Falk1 and Sergi Munne´ -Bosch Journal of Experimental Botany, Vol. 61, No. 6, pp. 1549–1566, 2010
- Vitamin Synthesis in Plants: Tocopherols and Carotenoids Dean Della Archiválva 2022. április 1-i dátummal a Wayback Machine-ben Penna1 and Barry J. Pogson2 1Department of Biochemistry and Molecular Biology, Michigan State University, East Lansing, Michigan 48824
- Review An Update on Vitamin E, Tocopherol and Tocotrienol—Perspectives Maria Laura Colombo
- [[https://web.archive.org/web/*/http://c0379343.cdn2.cloudfiles.rackspacecloud.com/23478_0_Blue_Print_For_Better_Health_Tocotrienols_Benefits.pdf halott link] A Peer-Reviewed Journal on Nutraceuticals and Nutrition][halott link] Mark Houston, MD Editor-in-Chief ISSN 1521-4524 Appropriate Spectrum Vitamin E and New Perspectives on Desmethyl Tocopherols and Tocotrienols by Barrie Tan, PhD © 2006 Kyäni, Inc.; Kyeni